-
(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)已知:S2O32-具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2,I2+2S2O32-→2I-+S4O62-则S2O82-、S4O62-、I2氧化性强弱顺序:_________.
(3) 已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
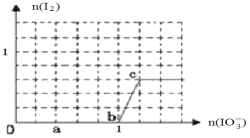
①写出a点处还原产物是_______________;b点到c点反应的离子方程式_________________________。
②当溶液中的I-为0.5 mol时,加入的KIO3为___________mol。
-
(1)铁及其化合物在生活、生产中有广泛的应用。请回答下列问题:
①黄铁矿(FeS2,二硫化亚铁)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为_____,若有3mol FeS2参加反应,转移__________mol电子。
②FeCl3与氢碘酸反应时可生成棕色物质I2,该反应的离子方程式为_________________。
(2)对反应NH3+O2—NO+H2O(未配平,反应条件略去)作分析,该反应中,还原剂是_______,还原产物是________,被还原的物质是_________。参加反应的氧化剂为3.2g时,反应转移的电子的物质的量为________________。
(3)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO ,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。
-
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2 6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________.
(3)将一定量的Fe2O3溶于160mL 5mol•L﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为______.
-
电化学原理在生活、生产中有非常广泛的应用,下列应用与电化学原理无关的是
A.“将光洁的工件加热至红热状,然后浸入水中”俗称烤蓝,是钢铁零件表面处理的一种防腐蚀工艺
B.远洋油轮船底镶嵌锌块
C.冶金工业冶炼某些活泼或较活泼金属
D.野外作业时,可用由铁屑、炭粒、食盐、水、空气组成的“热得快”来加热食品
-
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可 分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的 SO2、SO3 等气体,再向吸收液中加入浓硫酸,以制取高浓度的 SO2 及(NH4)2SO4和NH4HSO4固体。为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别 加入相同浓度的 NaOH 溶液 50.00 mL,加热至 120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于 200℃],测得有关实验数据如下(标准状况):

(1)由 1 组数据直接推测:1.81 g 样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用 NaOH 溶液的物质的量浓度 。
-
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。
-
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
(1)由1组数据直接推测:1.81g样品进行同样实验时,生成氨气的体积(标准状况)为___L。
(2)试计算该混合物中(NH4)2SO4和 NH4HSO4的物质的量之比为___。
(3)求所用NaOH溶液的物质的量浓度___mol/L。
-
工业生产硫酸的流程如下图所示。己知黄铁矿的主要成分是FeS2(二硫化亚铁)。
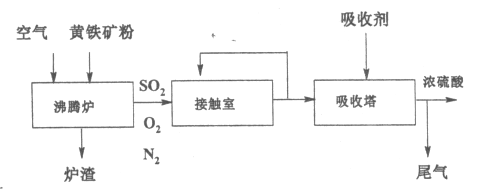
请回答下列问题:
(1)FeS2中铁元素的化合价是_____________。
(2)接触室中生成SO3的化学方程式是_____________________。
(3)从接触室中出来并被循环利用的物质是______________________。
(4)工业上采用氨水处理尾气中的SO2,请写出足量氨水和SO2反应的离子方程式____________________________________________。
-
氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:

仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
-
聚合硫酸铁是一种新型高效净水剂。以黄铁矿(主要成分:FeS2,铁的化合价为+2价)烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁(铁的化合价为+3价)的实验步骤如下:
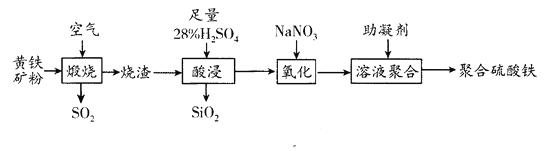
回答下列问题:
(1)用98%的浓硫酸配制28%的稀硫酸,需要的玻璃仪器除玻璃棒外,还需要________(填写仪器名称)。
(2)“煅烧”过程发生反应的氧化产物是___________________________;SO2氧化为SO3是工业生产硫酸的重要反应,写出该反应的化学方程式_______________________。
(3)写出“酸浸”过程中发生反应的离子方程式___________________________。
(4)“氧化”过程中先产生无色气体,最终变成红棕色气体,写出加入NaNO3产生无色气体反应的离子方程式______________________________,若用H2O2代替NaNO3达到相同氧化效果,消耗H2O2和NaNO3的物质的量之比___________。
(5)为确定产品是否合格,需测定聚合硫酸铁中Fe3+和SO42-的物质的量之比,测定时需要的试剂为___________ (填写序号)。
a. FeSO4 b. BaCl2 c. NaOH d. NaCl
,同时生成NH3,该反应的离子方程式为____________(提示:反应过程中N元素化合价不发生改变)。





