-
随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)z在元素周期表的位置是 。
(2)比较d、f简单离子的半径大小(用化学符号表示,下同) > ;
比较d、g元素的简单气态氢化物的稳定性大小 > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 。
(5)由上述元素组成的离子化合物 Q:eh 和 W:e2gd4,若电解含2 molQ和2 molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为 mol。
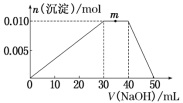
(6)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是 。
②写出m点发生反应的离子方程式 。
③若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
-
随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):_______>__________;________比较g、h的最高价氧化物对应水化物的酸性强弱:_______>__________。____________
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_________________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中逐滴加入1 mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化示意图如下:
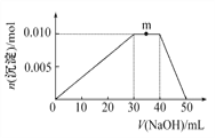
①写出m点反应的离子方程式:____________________________。
②若在R溶液中改加20 mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
-
【化学一选修3:物质结构与性质】
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
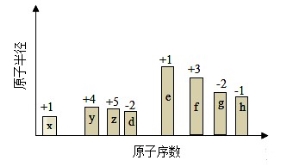
根据判断出的元素回答问题:
(1)f在元素周期表的位置是____。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_ _>____;比较g、h的最高价氧化物对应的水化物的酸性强弱是:__ _>_ _。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:①R离子浓度由大到小的顺序是:______ _。②写出m点反应的离子方程_ 。③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
-
(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
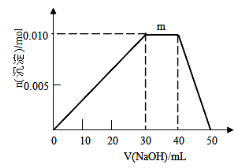
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
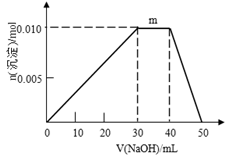
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
-
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
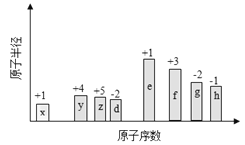
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
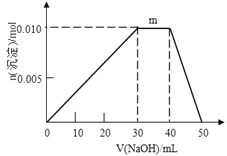
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
-
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
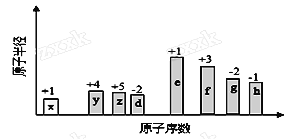
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
-
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
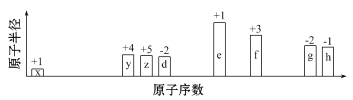
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)_______>_________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:_____________________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL1 mol/LR溶液的烧杯中滴加1 mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
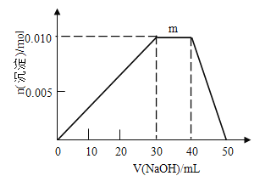
①写出m点反应的离子方程式____________________。
②若R溶液改加20 mL1.2 mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
-
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
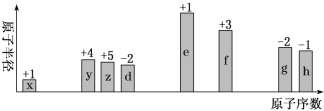
根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
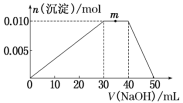
(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
-
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
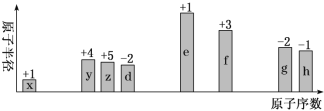
根据判断出的元素回答问题:
上述元素可组成盐R:zx4f(gd4)2。向盛有10mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
(1)R溶液中,离子浓度由大到小的顺序是___________________________________
(2)写出m点反应的离子方程式:__________________________________________。
(3)若在R溶液中改加20mL 1.2mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________ mol。
-
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
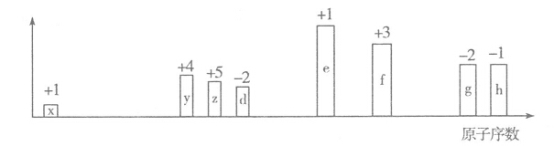
根据判断出的元素回答问题:
(1)y在元素周期表中的位置是 。z、d、e、f四种元素的简单离子中,半径最大的是 (填离子符号)
(2)e的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 。
(3)z的氢化物和h的氢化物反应形成化合物A,A中含有的化学键类型为 ;
(4)含f的某化合物可用作净水剂的原理是 (用离子方程式表示)
(5)25℃,f的最高价氧化物的水化物的Ksp=1.0 10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为 。
10-34,使含0.1 mol·L-1 f离子的溶液开始产生沉淀的pH为 。
(6)元素e和g组成的化合物B的水溶液中离子浓度由大到小的顺序为 。

















