-
明矾[KAl(SO4)2•12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3 及少量 SiO2 和 FeO•xFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 __,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______。
(2)明矾净水的原理是 ________(用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+ 的实验操作是 ________。
(4)在滤液 A 中加入高锰酸钾溶液的目的是 ______(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____。
(6)操作Ⅱ是 _____、______、过滤、洗涤、干燥。
-
(14分)
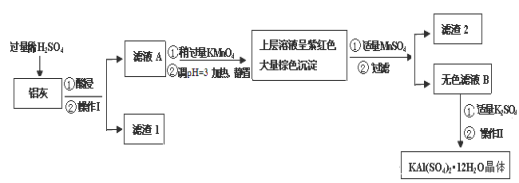
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
-
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
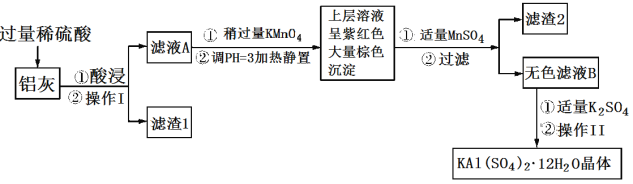
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
-
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:

(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(3)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4- 转化为Mn2+):
________________________________________。
(4)已知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为:________________________。滤渣2含有的物质是_______________。
-
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
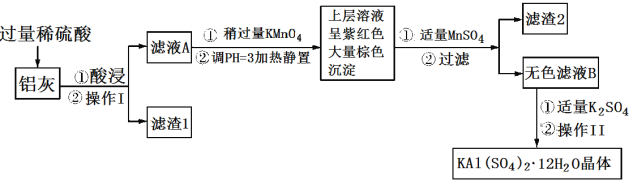
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_______________________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4—转化为Mn2+):________________。
(5)已知:在pH=3、加热条件下,MnO 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是_______________。
-
I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
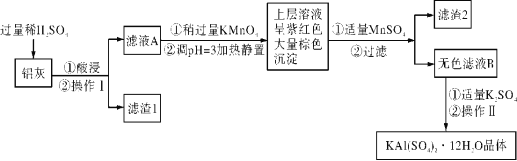
已知生成氢氧化物沉淀的pH如下表所示:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 | 3.4 | 6.3 | 1.5 |
| 完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
-
I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
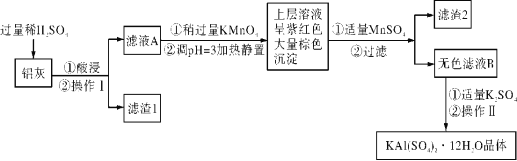
已知生成氢氧化物沉淀的pH如下表所示:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 | 3.4 | 6.3 | 1.5 |
| 完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
-
明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化:造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料-铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)明矾净水的原理是_______________(用离子方程式表示)
(2)操作I是__________,操作II是蒸发浓缩、____________、过滤、洗涤、干燥。
(3)将铝灰投入NaOH溶液中生成气体的化学方程式是_____________。在滤液A中加入KMnO4发生反应的离子方程式为_______________。
(4)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为___________________,滤渣2含有的物质是__________。
-
亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为____________。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
-
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。







