-
合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ΔH2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)⇌2NO2(g)的ΔH=________(用含ΔH1和ΔH2的式子表示)。一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=________。
(2)决定2NO(g)+O2(g)⇌2NO2(g)反应速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”“<”或“=”)。
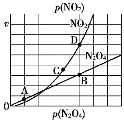
Ⅱ.(3)反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是____________________,理由是_________________________________________
(4)在25 ℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃时NH3·H2O的电离常数Kb=____。用质量分数为17%,密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=________ mL。
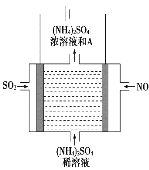
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为__________,阴极的电极反应式是_____________________________________________。
-
合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ΔH1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ΔH2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)⇌2NO2(g)的ΔH=________(用含ΔH1和ΔH2的式子表示)。一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=________。
(2)决定2NO(g)+O2(g)⇌2NO2(g)反应速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”“<”或“=”)。
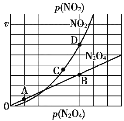
Ⅱ.(3)反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是____________________,理由是_________________________________________
(4)在25 ℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃时NH3·H2O的电离常数Kb=____。用质量分数为17%,密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=________ mL。
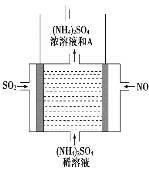
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为__________,阴极的电极反应式是_____________________________________________。
-
合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g) 2NO2(g)的∆H=________________(用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的∆H=________________(用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
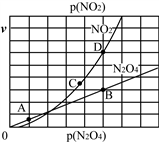
Ⅱ.(3)反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
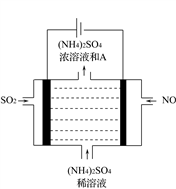
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。
-
合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) ∆H1<0
②N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) ∆H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g) 2NO2(g)的∆H=________________(用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的∆H=________________(用含∆H1和∆H2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g) 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

-
合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
① ;
; ;
;
② ,
, ;
;
③ ,
, ;
;
1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________。
(2)已知 的反应历程分两步:
的反应历程分两步:
① (快);
(快); ,
, ;
;
② (慢);
(慢); ,
,
一定温度下,反应 达到平衡状态,该反应的平衡常数的表达式K=____(用
达到平衡状态,该反应的平衡常数的表达式K=____(用 表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1____E2(填“>”“<”或“=”)。
(3)用活性炭还原法处理氮氧化物的有关反应为: 。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
。向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
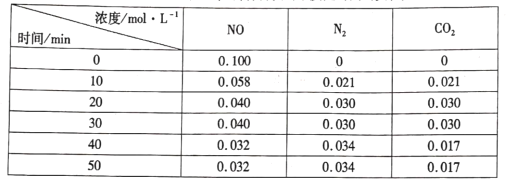
①T℃时,该反应的平衡常数的计算式为______。
②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____
③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(4)反应N2O4(g)  2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系: ,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
,其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
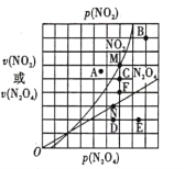
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______(填字母)。
-
合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574.0kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2 (g)+2H2O(g) △H=-1160.0 kJ/mol
③H2O(g)=H2O(1) △H=-44.0 kJ/mol
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(的热化学方程式是__________________。
(2)已知2NO(g)+O2(g) 2 NO2(g)的反应历程分两步:
2 NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2)
②N2O2(g)+O2(g) 2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
2 NO2(g) (慢) v2正=k2正·c (N2O2)·c(O2), v2逆=k2逆·c 2(NO2)
一定温度下,反应2NO(g)+O2(g) 2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
2 NO2(g)达到平衡状态,该反应的平衡常数的表达式K=______________________(用k1正、k1正、k2逆、k2逆表示),反应①的活化能E1与反应②的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)时,各物质的浓度随时间的变化如下表:
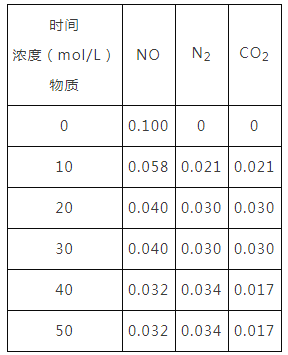
①T℃时,该反应的平衡常数为___________(保留两位有效数字)
②在31min时,若只改变某一条件使平衡发生移动,40min、50min时各物质的浓度如上表所示,则改变的条件是______________________。
③在51min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡___________(填“正向移动”、“逆向移动”或“不移动”)。
(4)反应N2O4(g) 2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
2NO2(g) △H>0,在一定条件下N2O4与NO2的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(N2O2)=k1·p(N2O4),v(NO2)=k2·p2(NO2)其中k1、k2是与温度有关的常数,相应的速率与N2O4或NO2的分压关系如图所示。
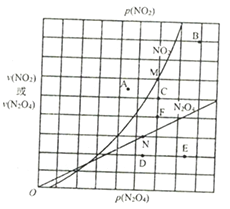
在T℃时,图中M、N点能表示该反应达到平衡状态,理由是______________________。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母)。
-
SO2 、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g)  SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
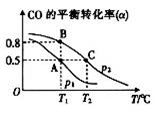
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。
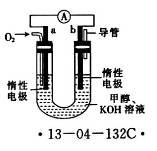
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
-
(10分)某课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题:
(1) 写出用铜与稀硝酸反应制取一氧化氮的离子方程式: ________________
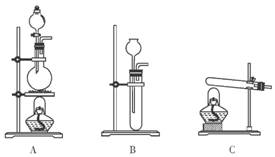
(2)查阅资料得知: 。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
(3)汽车尾气是当前城市大气污染的主要来源之一.汽车尾气中的主要污染物为一氧化碳和氮氧化物。汽车尾气催化转化装置可将这些有害气体转化为无害物质。该小组设计了如图所示的装置(部分夹持装置已略去).在实验室模拟汽车尾气处理的过程。
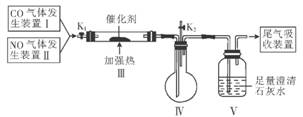
①实验前关闭K2,打开K1从K1处先通氮气排净装置中的空气,其目的是________
②装置III内发生反应的化学方程式为________
③实验过程中,装置V内可观察到的现象是________________
④实验结束后,关闭K1,停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
-
氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)已知反应I: 2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ·mol-1
2SO3(g),△H=-196.6kJ·mol-1
反应II: 2NO(g)+O2(g) 2NO2(g),△H=-113.0kJ·mol-1
2NO2(g),△H=-113.0kJ·mol-1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为________。
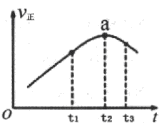
(2)①若在绝热恒容密闭容器中通入一定量的SO2和O2,一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如右图所示,则在a点时,反应______(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是___________。
②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:A _____B(填“>”、“=”、“< ” )。
(3)已知常温下,H2S的电离常数:K1=1.3×10-7, K2=7.1×10-15,则0.lmol/LH2S溶液的pH约为_______(取近似整数值);向浓度均为0.001mol·l-1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2-)为_______。(已知:Ksp(Ag2S)=6.3×10-50,Ksp(HgS)=1.6×10-52)
(4)NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术。现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为________。
-
研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g)  2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)  2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g)  N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g)  2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g)  2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g) 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
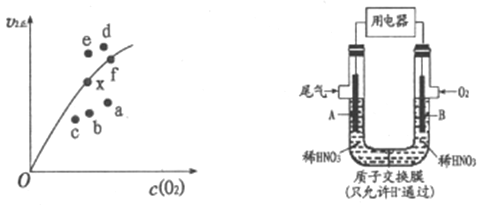
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH

















