-
“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g)  2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g)  2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g)  2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
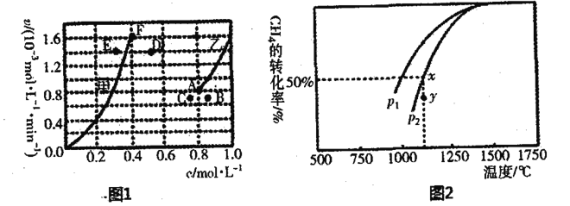
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。
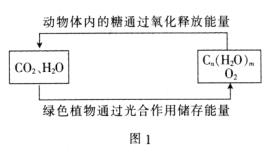
②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。将一定量的CO2(B)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g) 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41 kJ·mol-1
则反应CO2(g)+CH4(g) 2CO(g) +2H2(g)的△H =___________。
2CO(g) +2H2(g)的△H =___________。
(2)其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下,反应经过相同时间时,体系中CO含量随反应温度的变化如图1所示。
①在a点与c点对应的反应条件下,反应继续进行一段时间后达到平衡,平衡常数K(a 点)________K(c点 )( 填“>”“ <”或“=”)。
②b点CO含量低于c点的原因是____________________。
(3)为了探究反应:CO2(g) +CH4(g) 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图2):v正~c(CH4)和v逆~c(CO)。则与曲线v正~c(CH4)相对应的是图中曲线____________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为____________(填字母)。

(4)将足量CO2通入饱和氨水中可得氮肥NH4HCO3。在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
NH3·H2O+H2CO3的平衡常数K=_________(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka2=4×10-11)。
(5)科学家用氮化镓材料与铜组装成如图3所示的人工光合系统,利用该装置成功地实现了用CO2和H2O合成CH4。。氮化镓(GaN)表面发生__________(填“氧化”或“还 原”)反应,铜电极上的电极反应式为______________________。
-
“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
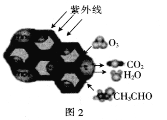
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+ O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
②为了探究反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。

(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 
| 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
-
“低碳经济”备受关注,CO2的捕捉、排集、利用成为科学家研究的重要课题。太空舱产生的 CO2用下列反应捕捉,以实现 O2的循环利用。
Sabatier 反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l) 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按 n(CO2)∶ n(H2)=1∶4 置于密闭容器中发生 Sabatier 反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
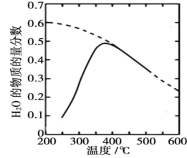
①该反应的平衡常数 K 随温度升高而________(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是________。
③下列措施能提高 CO2 转化效率的是________(填标号)。
A. 适当减压
B. 增大催化剂的比表面积
C. 反应器前段加热,后段冷却
D. 提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
(2)将一定量的 CO2(g)和 CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g) Δ H =+248 kJ·mol-1。
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
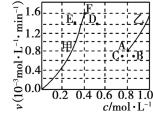
(3)用稀氨水喷雾捕集 CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s) ⇌2NH3(g)+CO2 (g)。实验测得的有关数据见下表( t1 < t2 < t3 )
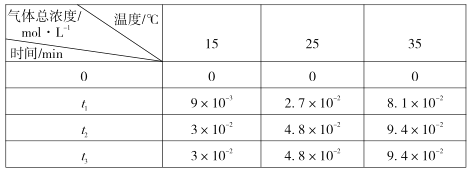
氨基甲酸铵分解反应是________(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =________。
(4)一种新的循环利用方案是用 Bosch 反应 CO2(g)+2H2(g) ⇌C(s)+2H2O(g)代替 Sabatier 反应。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJ∙mol-1 、–242 kJ∙mol-1 ,Bosch 反应的Δ H =________kJ∙mol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是________。
③该新方案的优点是________。
-
(14分)目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| | | | | | |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8mol•L﹣1 B.=1.4mol•L﹣1
C.<1.4mol•L﹣1 D.>1.4mol•L﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[ ] ] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L•min﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2mol•L﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
-
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)一定条下:C(s)+2H2O(g) CO2(g)+2H2(g)已知:C和H2的燃烧热分别为393.5KJ/mol和285.8KJ/mol,且H2O(1)=H2O(g) △H=+44.0KJ/mol.则该反应的△H= 。在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生此反应,其相关数据如下表所示:
CO2(g)+2H2(g)已知:C和H2的燃烧热分别为393.5KJ/mol和285.8KJ/mol,且H2O(1)=H2O(g) △H=+44.0KJ/mol.则该反应的△H= 。在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生此反应,其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
| | | | | |
①T1 T2(填“>”、“=”或“<”).
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5mol时,H2O(g)的物质的量的浓度 (填选项字母)。
A.=0.8mol/L B.=1.4mol/L C.< 1.4mol/L D.> 1.4mol/L
③T2℃下,乙容器中若起始充入a molCO2和b molH2,反应达到平衡时,测得CO2的转化率大于H2的转化率,则a/b的值需满足的条件为 。
(2)用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H1 取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的H1 0(填“>”、“<”或“=”)。
CH3OH(g)+H2O(g) △H1 取五份等体体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图1所示,则上述CO2转化为甲醇反应的H1 0(填“>”、“<”或“=”)。

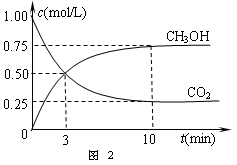
②在容积为1L的恒温密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图2所示。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g)(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)
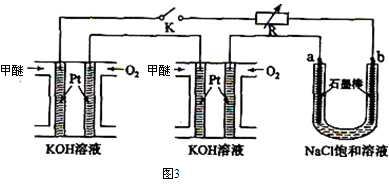
(3)CO2在一定的条件下,还可以转化为甲醚(CH3OCH3)。某研究小组将两个甲醚燃料电池串联后作为电源,电解饱和食盐水,装置如图3所示。
①请写出该甲醚燃料电池负极的电极反应式 。
②若U形管中氯化钠溶液的体积为600mL。闭合K后,若每个电池甲醚用量均为0.0112L(已折算到标准状况),且反应完全,假设产生的气体全部逸出,电解后溶液混合均匀,则电解后U形管中溶液的pH为 。
(4)常温下,用NaOH溶液吸收CO2得到pH=11的Na2CO3溶液,吸收过程中水的电离平衡将 移动(填“正向”、“不”、“逆向”);使计算溶液中 = 。(已知常温下,H2CO3的电离平衡常数为K1=4.4×10-2,K2=4.7×10-11)
= 。(已知常温下,H2CO3的电离平衡常数为K1=4.4×10-2,K2=4.7×10-11)
-
(14分)目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| | | | | | |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A.=0.8 mol·L-1 B.=1.4 mol·L-1
C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A.0.6 mol 1.0 mol 0.5 mol 1.0 mol
B.0.6 mol 2.0 mol 0 mol 0 mol
C.1.0 mol 2.0 mol 1.0 mol 2.0 mol
D.0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
-
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙 粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
粒子直径在1-100nm之间)。①向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入CO2,制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______.
(2)一定条件下,C(s)和H2O(g)反应,能生成CO2(g)和H2(g),将C(s)和H2O(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H2O(g) CO2(g)+2H2(g)其相关数 据如下表所示:
CO2(g)+2H2(g)其相关数 据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/mol |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | 
| 2 | 4 | 
| 8 |
| 乙 | 1 | 
| 1 | 2 | 
| 3 |
①T1℃时,该反应的平衡常数 ______
______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 ____  填选项字母
填选项字母 .
.
A、=0.8mol·L-1 B、=1.4mol·L-1 C、<1.4mol·L-1 D、>1.4mol·L-1
③丙容器的容积为1L,T2℃时,起始充入a mol CO2(g)和b mol H2(g),反应达到平衡时,测得CO2的转化率大于 的转化率,则
的转化率,则 的值需满足的条件为 ______;
的值需满足的条件为 ______;
④丁容器的容积为1L, 时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______
时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 ______ 填选项字母
填选项字母 .
.
A 0.6mol、1.0mol、0.5mol、1.0mol
B 0.6mol、2.0mol、0 mol、0 mol
C 1.0mol、2.0mol、1.0mol、2.0mol
D 0.25mol、0.5mol、0.75mol、1.5mol
(3)CO2在一定条件下可转化为甲醚CH3OCH3用甲醚燃料电池做电源,用惰性电极电 解饱和K2SO4溶液可制取H2SO4和KOH,实验装置如图所示
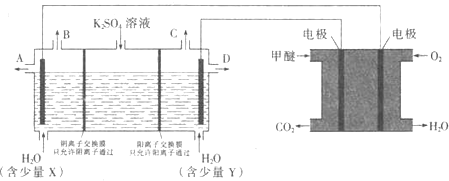
 甲醚燃料电池的负极反应式为 ______
甲醚燃料电池的负极反应式为 ______
 口导出的物质为 ______
口导出的物质为 ______  填化学式
填化学式 .
.
 若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为 ______.
若燃料电池通入CH3OCH3(g)的速率为0.1mol·L-1·min-1,2min时,理论上C 口收集 到标准状况下气体的体积为 ______.
-
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| | | | | | |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填字母)。
A.=0.8 mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填字母)。
A.0.6 mo l 1.0 mol 0.5 mol 1.0 mol
l 1.0 mol 0.5 mol 1.0 mol
B.0.6 mol 2.0 mol 0 mol 0 mol
C.1.0 mol 2.0 mol 1.0 mol 2.0 mol
D.0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1. 12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
-
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min |
| C(s) | H2O(g) | H2(g) |
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol·L-1 B.=1.4 mol·L-1 C.<1.4 mol·L-1 D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g) CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
2CO(g)+2H2(g)
2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1












