-
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的Fe2+含量,请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式_________(K2Cr2O7被还原为Cr3+)。
(2)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取K2Cr2O7________ g(保留四位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器一定不会用到的有________。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(3)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将____________________________。
(4)用0.010 00 mol·L-1的K2Cr2O7溶液滴定20.00 mL未知浓度的含Fe2+的溶液。恰好完全反应时消耗10.00 mL K2Cr2O7溶液,则溶液中Fe2+的物质的量浓度是多少?_________________。
高二化学实验题中等难度题查看答案及解析
-
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管
(2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
以下为废水中铬元素总浓度的测定方法:_______________________
准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
③I2+2S2O32-===2I-+S4O62-
(3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
测定产品(Na2S2O3·5H2O)纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I-

①滴定至终点时,溶液颜色的变化:________。
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
高二化学综合题困难题查看答案及解析
-
Ⅰ.用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________ g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
Ⅱ.四氯化硅粗产品经精馏后,得到的残留物中常含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O。
滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________。
Ⅲ.某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______作滴定指示剂,滴定终点的现象是_______________________________。
②CuCl2溶液与KI反应的离子方程式为________________________________________。
③碘与硫代硫酸钠反应的离子方程式是________________________________________。
④该试样中CuCl2·2H2O的质量百分数为________。
高二化学简答题中等难度题查看答案及解析
-
中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
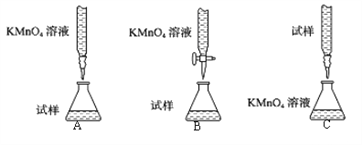
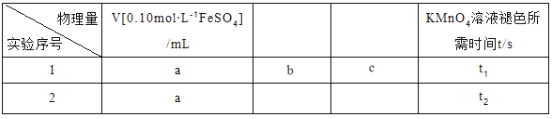
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10mol∙L-1FeSO4、0.02mol∙L-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
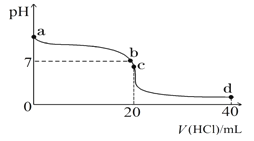
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
高二化学实验题中等难度题查看答案及解析
-
中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
I.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。
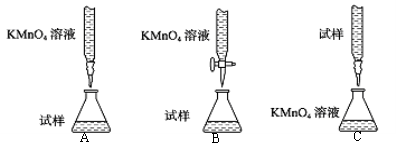
②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、药匙、玻璃棒、烧杯、量筒外,还需要 (填仪器名称)。
Ⅱ.探究小组乙测定NH3•H2O的浓度及电离平衡常数Kb
常温下,探究小组量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据, 溶液的pH随加入盐酸体积的变化曲线如图所示。
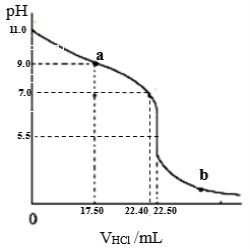
(2)如图:a>7.0的理由是(用电离方程式表示) 。
(3)如图,当加入稀盐酸的体积为22.40mL时,此时溶液中c(Cl—) c(NH4+)(填<、>或=)。
当加入稀盐酸的体积至b点溶液中离子浓度大小关系为_________。
(4)结合图信息,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= 。
(5)关于该滴定实验的说法中,正确的是 。
A. 锥形瓶中有少量蒸馏水不影响测定结果
B. 锥形瓶未用氨水进行润洗会导致测得氨水的浓度偏低
C. 酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D. 滴定终点时俯视读数会导致测得氨水的浓度偏高
高二化学实验题困难题查看答案及解析
-
已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72−(橙色) + H2O
2CrO42−(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
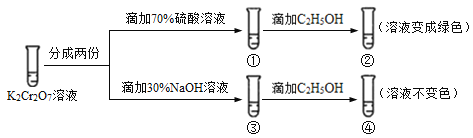
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72−被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
高二化学单选题中等难度题查看答案及解析
-
(10分)已知草酸晶体(
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定
第二次滴定
第三次滴定
待测溶液体积(mL)
25.00
25.00
25.00
标准溶液体积(mL)
9.99
10.01
10.00
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
高二化学实验题中等难度题查看答案及解析
-
已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
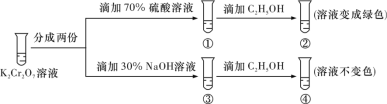
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
高二化学单选题中等难度题查看答案及解析
-
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O.用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL纯净的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,经测定溶液的pH是3
②向滤液中加入双氧水,搅拌.
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤.
④把③所得滤液浓缩.
填空:
(1)②中发生反应的离子方程式是______.
(2)③中过滤后滤渣的成分是______.
(3)①③中如何用pH试纸测定溶液的pH值:______.
(4)③中pH升高的原因是:______.(用离子方程式表示)高二化学解答题中等难度题查看答案及解析
-
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O.用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL纯净的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,经测定溶液的pH是3。
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
填空:
(1)②中发生反应的离子方程式是________;
(2)③中过滤后滤渣的成分是________;
(3)①③中如何用pH试纸测定溶液的pH值:________;
(4)直接加热溶液,蒸干________(选填“能”或“不能”)得到氯化铜晶体(CuCl2·2H2O),原因是________。
高二化学填空题中等难度题查看答案及解析