-
砷是生命的第七元素,可形成多种重要化合物,如雌黄(As2S3)、雄黄(As4S4)、砷酸(H3AsO4)和亚砷酸(H3AsO3)等。
(1)雄黄可入药。若0.5mo1雄黄与O2反应生成As2O3,转移14mol电子,则另一种产物为______________(填化学式)。
(2)砷酸(H3AsO4)是一种重要化工产品,可与足量NaOH溶液反应生成Na3AsO4。NaH2AsO4溶液水解反应的Kh=_________,该溶液显______(填“酸”或“碱”)性。若向该溶液中加入少量NaOH固体,则溶液中 将_______(填“增大”、“减小”或“不变”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
将_______(填“增大”、“减小”或“不变”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
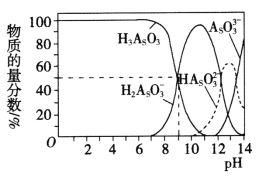
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________,pH=8时,溶液中,c(Na+)________c(H2AsO3-)(填“>”、“<”或“=”)。
-
砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH- AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
-
砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s) +  H2(g) +2O2(g) =H3AsO4(s) ΔHl
H2(g) +2O2(g) =H3AsO4(s) ΔHl
H2(g) +  O2(g) =H2O(1) ΔH2
O2(g) =H2O(1) ΔH2
As(s)+  O2(g)=
O2(g)=  As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(g) +3H2O(1) = 2H3AsO4(s) ΔH=_________。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________。
(3)NaH2AsO4溶液呈______(填“酸性”、“中性”或“碱性”),试通过计算说明________________________。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。
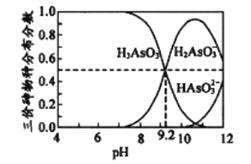
以酚酞为指示剂(变色范围pH8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________。
(5)某化学兴趣小组同学欲探究可逆反应AsO33-+I2+2OH- AsO43-+2I-+ H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
AsO43-+2I-+ H2O。设计如下图I所示装置。实验操作及现象:按图I装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图I装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图II所示。
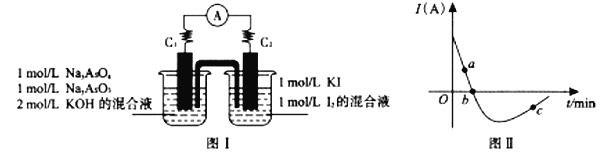
①图II中AsO43-的逆反应速率:a____b( 填“ >”、” <”或“ =” )。
②写出图II中c点对应图I装置的正极反应式__________________________。
③能判断该反应达到平衡状态的是________________。
a.2v(I-)正=v(AsO33-)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
-
砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+ O2(g)=
O2(g)= As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
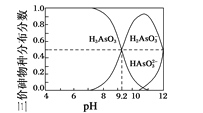
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH- AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
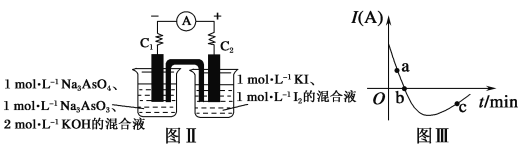
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
-
元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
-
元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
-
(本题10分)
元素的单质及其化合物有着广泛的用途。请根据元素周期表中第三周期元素相关知识回答下列问题。
完成下列填空:
23.按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
A.原子半径和简单离子半径均减小
B.金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
24.原子最外层电子数与次外层中p亚层电子数相同的元素名称是__________,磷元素原子最外层电子排布的轨道表示式是________________________________。
25.已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_______________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是___________________________________。
26.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________________。
27.KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式: _______________
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
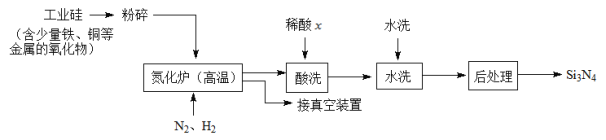
①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。 可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
-
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。

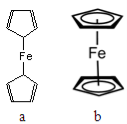
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________;
(2)写出M原子核外能量最高的电子的电子排布式:__________________;
(3)常温下,不能与R单质发生反应的是___________(选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(4)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
II.氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
(5)Si3N4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C3N4的结构与Si3N4相似。请比较二者熔点高低。并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。_________________
(8)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_____________。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。








