-
造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3·H2O吸收。
已知2NH3·H2O (aq) + H2SO4(aq)==(NH4)2SO4(aq)+ 2H2O(l) △H=-24.2kJ/mol,中和热△H=-57.3 kJ/mol则1mol NH3·H2O理论上完全电离时需要吸收的热量为________。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
| pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___________。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式_______。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4mol SO2,发生SO2(g)+NO2(g)  SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
SO3(g)+NO(g) △H=-41.8 kJ/mol 在不同温度下测定同一时刻NO2的转化率,结果如下图所示。
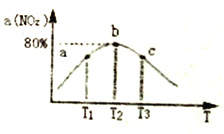
①a、c两点反应速率大小关系: v(a) ___v(c)。(填“>”、“<” 或“=”)
②温度为T2时从反应开始经过2min 达到b点,用SO3表示这段时间的反应速率为______,此温度下该反应的平衡常数为_______。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率_______(填“增大”、“减小”或“不变”).
③NO2的转化率随温度升高先增大后减小的原因是____________。
-
造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3•H2O吸收。已知2NH3•H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3•H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
| pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4∼7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)⇌SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。
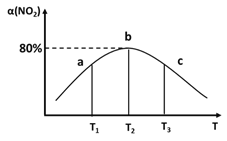
①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。
-
Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
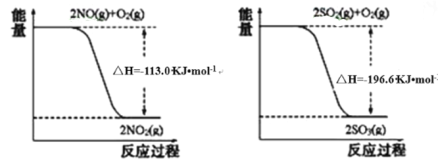
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
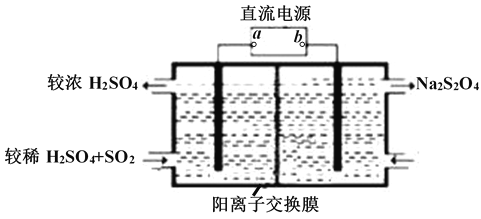
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
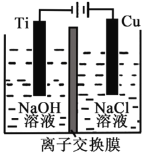
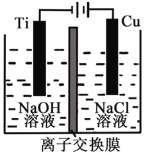
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
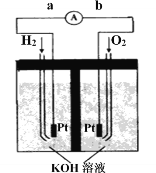
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
-
Ⅰ.氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式_____________。
(2)常温下用NaOH溶液吸收SO2,当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,利用图所示装置(电极均为惰性电极)在pH为4~7之间电解,可使NaHSO3转化为Na2S2O4,并获得较浓的硫酸,这是电化学脱硫技术之一,
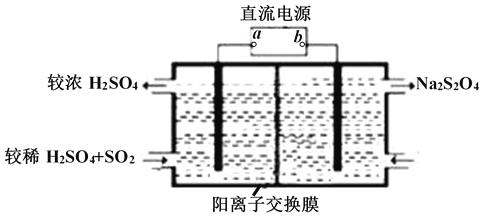
①a为电源的_______(填 “正极”或“负极”);
②阴极的电极反应式为______
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,反应为2Cu + H2O ==Cu2O + H2↑。装置如图所示:该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:____________________,钛极附近的pH_______ (增大、减小、不变)。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
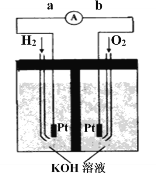
①氢氧燃料电池的能量转化主要形式是________,工作时电流方向为_______(用a→b或b→a表示)。
②负极的电极反应式为__________________。
-
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关。
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2。
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是 (填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式 ,若利用B和C制备等量的氧气,则转移的电子数目之比为 。
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下:
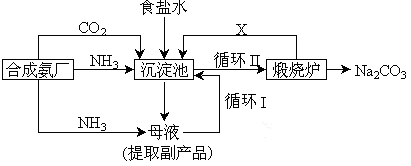
①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是 。
②检验产品碳酸钠中是否含有氯化钠的操作方法为 。
③写出上述流程中X物质的分子式 ,副产品的一种用途为 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
-
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2.
则NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是______.
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.亚硫酸钠固体中加入H2SO4 D.制备乙酸乙酯时加入浓H2SO4
(2)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______,其水解反应的平衡常数(即水解常数)的表达式为Kh=______.
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=______.
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=______[用含c(HCO-3)、c(H2CO3)的关系式表示].
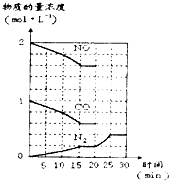
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、lmolCO充入固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).该温度下,反应的化学平衡常数为:K=______(用分数表示).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④
-
燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、浯化能数据如下:
反应I: NO(g)+O3(g)  NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
NO2(g)+ O2(g) △H1=-200.9kJ/mol' Ea1=3.2 kJ/mol.
反应Ⅱ:SO2(g))+ O3(g) SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2= 58 kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g)  3O2(g) 请回答:
3O2(g) 请回答:
(1)已知反应I在低温下自发进行,则该反应的熵变△S___________0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0 mol NO、10 mol SO2的模拟烟气和2.0 molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:
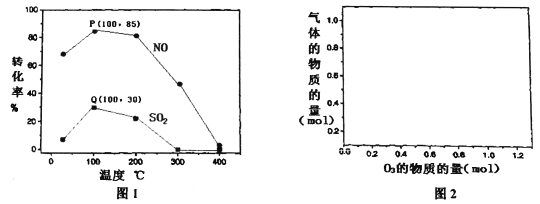
①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_________。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是______mol。
③下列说法正确的是_______。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)150℃条件下,向反应器中充入含1molNO、1molSO2的模拟烟气,在图2中分别画出NO和SO2的物质的量随O3量的变化曲线。________
(4)工业上可以通过电解NO制备NH4NO3,原理如图3所示。写出电解过程阳极的电极反应式_______。
-
大气中SO2和NOx是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等。某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份酸化后滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。已知:Ksp(Ag2SO4) = 1.20×10-5,请回答下列问题:
(1)该酸雨中肯定存在的离子有 ;肯定不存在的离子有 ,说明其不存在的理由:
。
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式: 。
(3)设计实验方案,检验该试液中是否存在Cl-: 。
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有 、 ,再喷射适量蒸馏水即得硫酸型酸雨,说明NO的作用: 。
-
大气中SO2和NOx是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:第一份滴加适量的淀粉KI溶液,呈蓝色;第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
(1)该酸雨中肯定存在的离子有______;肯定不存在的离子有______,说明其不存在的理由:______.
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:______.
(3)设计实验方案,检验该试液中是否存在Cl-:______.
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有______、______,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:______.
-
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案:
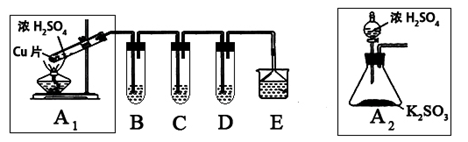
(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体___________________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:______________________________________________ ___________________________________________________ | _________________________ |














