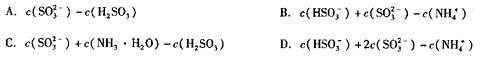-
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、101KPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化为SO3(g)的热化学方程式为______________________。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)⇌2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为______________________。
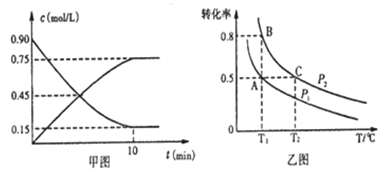
②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1____________P2(填>、=或<);A、B、C 三点的平衡常数大小关系是______(用KA、KB、KC和>、=、<表示)。理由是____________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为____________。所得溶液中c(H+)-c(OH-)= ______(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3•H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
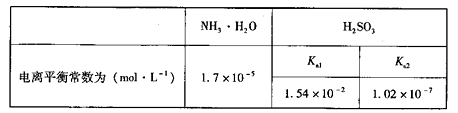
②已知:在25℃时NH3•H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为___________________________。
| NH3•H2O | H2SO3 |
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 |
| | | |
-
(17分)硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
(i)2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l)ΔH=-457kJ/mol
(ii)SO3(g) +H2O(l)=H2SO4(l)ΔH=-130kJ/mol
则SO2催化氧化反应中,每生成l mol SO3(g)的焓变为_____kJ·mol-1。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)  2SO3(g)。
2SO3(g)。
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为____。
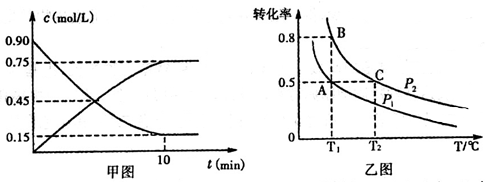
②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图所示。则P1与P2的大小关系是P1____ P2(填>、=或<);A、B、C三点的平衡常数大小关系是____(用KA、KB、KC和 >、=、<表示)。
(3)为研究H2SO4生产中SO3催化氧化时温度对SO2平衡转化率的影响,进行如下试验。取100 L原料气(体积分数为SO27%、O2 11%、N282%)使之发生反应,在10l kPa下达到平衡,得到如下数据:

根据上述数据,575℃达平衡时,SO3的体积分数为______%(保留一位小数)。
(4)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3∙H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②工业上用足量氨水吸收硫酸工业废气。吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性,则吸收Cl2后的溶液中一定存在的阴离子有OH-和_____。
-
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、l0l kPa时:
①2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l) ΔH=-457kJ/mol
②SO3(g) +H2O(l)=H2SO4(l) ΔH=-130kJ/mol
则SO2催化氧化为SO3(g)的热化学方程式为__________________。
(2)对于SO3催化氧化为SO3的反应。
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为________________。

②在一容积可变的密闭容器中充入20mol SO2(g)和l0 mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1________________ P2(填>、=或<);A、B、C三点的平衡常数大小关系为____________(用KA、KB、KC和 >、=、<表示),理由是______________________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为__________,所得溶液中c(H+)-c(OH-)=___________(填序号)。
A.c(SO32-)-c(H2SO3)
B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3∙H2O)-c(H2SO3)
D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中各离子浓度由大到小的顺序为_____________________。
| NH3·H2O | H2SO3 |
| 电离平衡常数(mol/L) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 |
| | | |
-
硫酸在生活和生产中应用广泛。某工厂以黄铁矿(主要成分为FeS2)为原料,采用接触法制备硫酸。
(1)已知在298 K和101 kPa条件下:
FeS2(s)=FeS(s)+S(s) ∆H1
S(s)+ O2(g)=SO2(g) ∆H2
4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) ∆H3
则在该条件下FeS2与O2生成Fe2O3和SO2的热化学方程式为_______。
(2)催化氧化反应:2SO2(g) +O2(g) 2SO3(g) ∆H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
2SO3(g) ∆H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
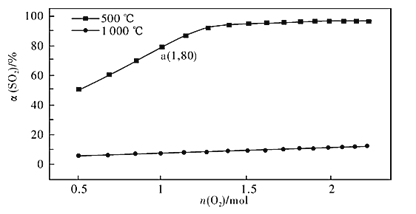
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=_________Pa(保留两位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图______:
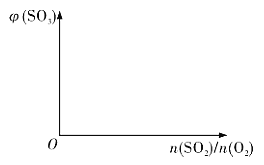
(4)已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活性氧的反应历程与能量变化关系如图所示。下列说法不正确的是_______(填字母代号)。
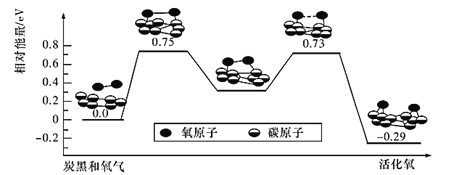
A.O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程
B.该过程的最大能垒(活化能)E正=0.73 eV
C.每活化一个O2分子最终吸收0. 29 eV能量
D.依题炭黑可以作为SO2转化为SO3的催化剂
E.其他条件相同时,炭黑颗粒越小,反应速率越快
(5)硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极反应式:___________
-
(18分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。 ’
①已知25℃.10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为 mol,此反应的化学方程式是 。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:
V2+-e一=V3+。
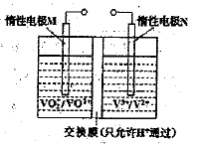
①电池放电时的总反应方程式为 。
充电时,电极M应接电源的 极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+) (填“增大”、“不变”或“减小”),阳极的电极反应式为: 。
-
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①已知25℃,10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
则反应2SO2(g)+O2(g) 2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为______mol,此反应的化学方程式是___________________________。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:V2+-e一=V3+。
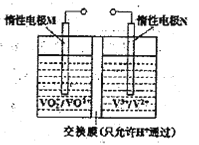
①电池放电时的总反应方程式为____________。充电时,电极M应接电源的____________极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)______(填“增大”、“不变”或“减小”),阳极的电极反应式为:_______________。
-
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:
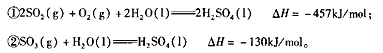
则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为
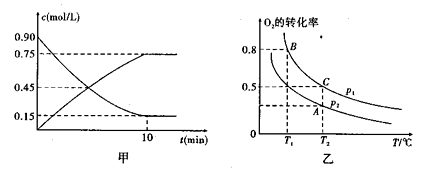
②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 ( ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中 = (填序号)。
= (填序号)。
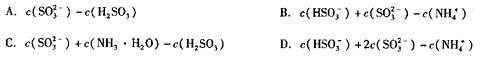
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
-
氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1mol化合物的焓变。已知25℃和101kPa
时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g) +6H2O(l) △H=-3116 kJ·mol-1
②C(石墨,s)+O2(g) =CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:___________________________________________。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H<0。某温度下,若将1mol N2和2.8mol H2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度下,若将1mol N2和2.8mol H2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
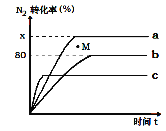
①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)
②曲线a条件下该反应的平衡常数K=_________。
③b容器中M点,v(正)____v(逆)(填“大于”、“小于”或“等于”)
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为______;标准状况下,当阴极收集到11.2 LN2时,理论上消耗NH3的体积为_____。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)  Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O  [Cu (NH3) 4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu (NH3) 4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s) +4NH3·H2O  [Cu (NH3) 4]2++4H2O+2OH-配制铜氨溶液是否可行:_________________________________________。
[Cu (NH3) 4]2++4H2O+2OH-配制铜氨溶液是否可行:_________________________________________。
②已知反应Cu(OH)2(S) +2NH3·H2O+2NH 4+  [Cu (NH3) 4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol·L-1的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为_______________;解释出现该现象的原因是_____________________。
[Cu (NH3) 4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol·L-1的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为_______________;解释出现该现象的原因是_____________________。
-
氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s) Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+ [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
-
钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJ•mol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJ•mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:

查阅相关资料可知:
| 离子种类 | VO2+ | VO2+ | V3+ | V2+ |
| 颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。









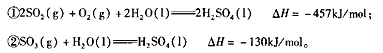

 ),理由是
),理由是