-
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)试写出SiCl4的电子式_____________________________。
(2)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的物质的量增加了0.02mol,则H2的平均反应速率为____________________。
(3)上述反应达到平衡后,下列说法正确的是__________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量平衡向左移动
d.其他条件不变,增大HCl的浓度平衡向左移动
(4)一定条件下,在恒容密闭的容器中,能表示上述反应达到化学平衡状态的是_____。
a.3v逆(N2)= v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
e.单位时间内有n molN2消耗的同时有6 molHCl生成
(5)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比_______m:n(填“>”、“=”或“<”)。
-
(14分)Ⅰ.用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________;
(2)上述反应达到平衡后,下列说法正确的是__________。
A.其他条件不变,压强增大,平衡常数K减小
B.其他条件不变,温度升高,平衡常数K减小
C.其他条件不变,增大Si3N4物质的量平衡向左移动
D.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_____。
A.3v逆(N2)= v正(H2) B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变 D.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___m:n(填“>”、“=”或“<”)。
Ⅱ.铬是人体必需的一种微量元素,但是铬过量摄入对人体造成的危害非常大。目前对含铬废水的处理通常是将毒性较强的六价铬转化为毒性较弱的三价铬。某工业废水中含有一定量的Cr2O72—和CrO42—,处理方法之一为“还原沉淀法”,该法的工艺流程为:
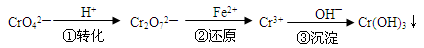
其中第①步存在平衡:2CrO42—(黄色) + 2H+ Cr2O72—(橙色) + H2O
Cr2O72—(橙色) + H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.c(Cr2O72—)= c(CrO42—)
B.2v(Cr2O72—) =v(CrO42—)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—,需要_______mol的FeSO4·7H2O。
-
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) =Si3N4(s)+12HCl(g)+Q(Q>0)完成下列填空:
(1)写出N2的电子式:___________________,写出SiCl4的结构式:______________。
(2)由氮化硅(Si3N4)陶瓷的用途可推测其晶体类型为________。
a.离子晶体 b. 原子晶体 c.分子晶体 d.金属晶体
(3)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min)。
(4)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(5)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,正反应速率减小
b.其他条件不变,温度升高,正、逆反应速率都增大
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(6)若平衡时H2和HCl的物质的量之比为 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___ (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
-
我国及美国、日本等国家都已研制出一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )。
A.氧化铝陶瓷 B.氮化硅陶瓷
C.光导纤维 D.玻璃钢
-
我国及美国、日本等国家都已研制出了一种陶瓷柴油机。这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是( )
A. 硅钢 B. 氮化硅陶瓷 C. 光导纤维 D. 玻璃钢
-
氮化硅(Si3N4)是一种重要的结构陶瓷材料,属于新型功能性陶瓷产品,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
(1)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:_________。
(2)现用四氧化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅及氯化氢,反应的化学方程式为____。
(3)沸石是一种含结晶水的、具有多孔结构的铝硅酸盐,化学式为Na2[Al2Si3O10(H2O)2],若以氧化物形式可表示为_________。
-
(8分).氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。
A.制汽轮机叶片 B.制有色玻璃 C.制永久性模具 D.制造柴油机
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为________。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为________。
-
氮化硅(Si3N4)是一种高温陶瓷材料,它难溶于水、硬度大、熔点高、化学性质稳定。则由此推测氮化硅是 ( )
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
-
氮化硅(Si3N4)是一种高温陶瓷材料,它难溶于水、硬度大、熔点高、化学性质稳定。则由此推测氮化硅是
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
-
氮化硅(Si3N4)是一种高温陶瓷材料,它难溶于水、硬度大、熔点高、化学性质稳定。则由此推测氮化硅是 ( )
A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
Si3N4(s)+12HCl(g) ΔH <0