-
有难溶于水的粉末状固体样品,可能含有Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种,研究小组通过实验确定样品的成分.
【查阅资料知】① Cu2O + 2H+ = Cu + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
物质
Fe(OH)3
Fe(OH)2
Cu(OH)2
开始沉淀的pH
1.8
6.3
5.2
完全沉淀的pH
3.0
8.3
6.7
【注】金属离子的起始浓度为0.1 mol·L-1
【实验步骤】
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀.
请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为 .
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 .
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 .
(4)Ⅳ中加NaClO的目的是 .
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g.
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合为
(用化学式表示).
高三化学填空题困难题查看答案及解析
-
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
① Cu2O + 2H+ = Cu + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
物质
Fe(OH)3
Fe(OH)2
Cu(OH)2
开始沉淀的pH
1.8
6.3
5.2
完全沉淀的pH
3.0
8.3
6.7
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是 ;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为 ;若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为
组合1: ;组合2: ;……(用化学式表示)
高三化学实验题极难题查看答案及解析
-
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:Cu2O + 2H+ = Cu + Cu2+ + H2O;
部分氢氧化物在溶液中沉淀的pH见下表:
物质
Fe(OH)3
Fe(OH)2
Cu(OH)2
开始沉淀的pH
1.8
6.3
5.2
完全沉淀的pH
3.0
8.3
6.7
注:金属离子的起始浓度为0.1 mol·L-1 实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为 。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是 。
(3)溶液C中除H+、Cu2+外一定还含有另一种阳离子;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是 。
(4)Ⅳ中加NaClO的目的是 。
(5)将Ⅳ中得到的溶液D电解,若电路中有0.1mol电子通过,则理论上阴极质量增重 g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为组合1: ;组合2:
;……(用化学式表示)
高三化学填空题困难题查看答案及解析
-
(19分)某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:
探究一:用下图所示装置进行实验,回答下列问题:
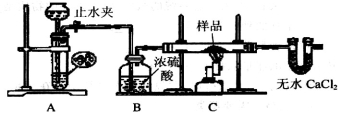
(1)仪器组装完成后,夹好止水夹,__________.则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是_________(填选项)
A.稀硫酸和锌片 B.稀硝酸和铁片
C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号)
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用___________方法收集氢气。
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确_________。(填“是”或“否”)若填“否”,则原因是_________(用离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体。
证明样品中一定含有__________,取少量反应后的溶液,加适量蒸馏水稀释后,滴加_________(填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中
有1.0mol,则样品中
___________mol。
高三化学实验题极难题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
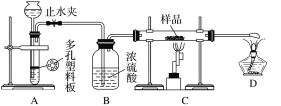
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
高三化学实验题困难题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
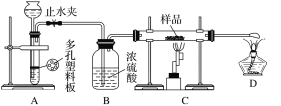
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
高三化学实验题困难题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成.回答下列问题:

(1)仪器组装完成后,夹好止水夹,__________________,则说明装置A的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:_____________________(填序号)。
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设
和判断,结论正确的是________。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有________,写出产生上述气体的化学方程式_______________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体3.2g,测得滤液中Fe2+有1.0 mol,则样品中n(Cu2O)=_______________mol。
高三化学实验题困难题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+===Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
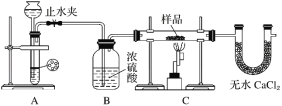
(1)仪器组装完成后,夹好止水夹,___________________________________________,则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)。
A.稀硫酸和锌片 B.稀硝酸和铁片 C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号)。
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确________(填“是”或“否”),若填“否”,则原因是_________________________________(用离子方程式说明);
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体,证明样品中一定含有__________,取少量反应后的溶液,加适量蒸馏水稀释后,滴加_____________________(填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=________mol。
高三化学实验题中等难度题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究.
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu + Cu2++H2O
探究一:用下图所示装置进行实验,回答下列问题:
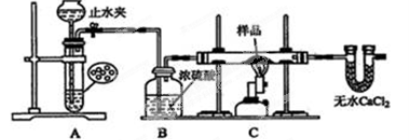
(1)仪器组装完成后,夹好止水夹, ,则说明装置A的气密性良好;
(2)装置A是氢气的发生装置,可以选用的药品是 (填选项)
A.稀硫酸和锌片 B.稀硝酸和铁片
C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:① ③(填序号)
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹 ④点燃C处的酒精喷灯 ⑤收集氢气并验纯 ⑥通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用 方法收集氢气.
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确 (填“是”或“否”)若填“否”,则原因是 (用离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有 ,取少量反应后的溶液,加适量蒸馏水稀释后,滴加 (填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分.
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0 mol,则样品中n(Cu2O)= mol.
高三化学实验题困难题查看答案及解析
-
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
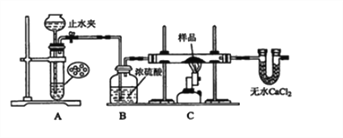
(1)仪器组装完成后,夹好止水夹,______________________ ,则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是______(填选项)
A.稀硫酸和锌片 B.稀硝酸和铁片
C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①____________③(填序号)。
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________(用离子方程式表示);丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学设计实验证明另一种物质是否存在,则其设计方案中检验另一种物质所有试剂名称为______________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
高三化学实验题中等难度题查看答案及解析