-
辉铜矿的主要成分是Cu2S,可用于制取金属铜和铜盐。
(1)己知部分反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) ΔH1=akJ·mol-1
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) ΔH2=bkJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH3=ckJ·mol-1
则C(s)+2Cu2S(s)=4Cu(s)+CS2(g)的ΔH=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为_______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是______________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是_____________。

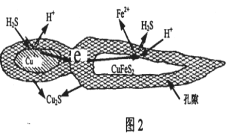
③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:__________,CuCl+FeCl3=CuCl2+FeCl2。
(3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为_________________。
(4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)  Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
-
利用化学反应原理研究碳、硫及其化合物的性质具有重要意义。
(1)工业上用炭还原辉铜矿(主要成分是Cu2S) ,可制取金属铜。
己知反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) △H1=150 kJ/mol
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) △H2=59.5kJ/mol
2H2S(g)=2H2(g)+S2(g) △H3 =170kJ/mol
通过计算,可知用炭还原Cu2S 制取金属铜和CS2(g) 的热化学方程式为_________。
(2)为研究反应2H2S(g) 2H2(g) +S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
2H2(g) +S2(g)对上述工业过程的影响,兴趣小组进行如下探究:
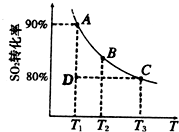
①向三个体积均为1L的恒容密闭容器中分别加入1molH2S,进行H2S分解实验。不同温度下测得H2S 的转化率与时间的关系如下图所示:
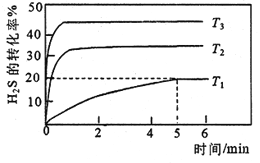
T1温度下,0~5min S2(g)的平均反应速率v(S2)= _____mol.L-1.min-1,反应平衡常数K=_____mol.L-1。温度T1、T2、T3 由高到低的顺序是________。
②T4 温度时,向1L的恒容密闭容器中加入1.8molH2(g)、1.2molS2(g),达到平衡后测得S2(g)和H2S(g)的浓度相等,则T4______ T1 (填“<”、“=”或“>”)。
(3)T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中三种微粒H2C2O4、HC2O4-、C2O42- 的物质的量分数(δ) 与pH的关系如下图所示:
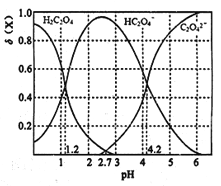
①草酸的电离常数分别为K1与K2,则 =______。
=______。
②按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是____(填序号)。
A. 该溶液的pH为4.2
B. 3c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
C. 3c(Na+)=5[c(HC2O4-)+c(C2O42-) +c(H2C2O4)]
D. 3c(OH-)+c(C2O42-)=3c(H+)+2c(HC2O4-)+5c(H2C2O4)
-
高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。
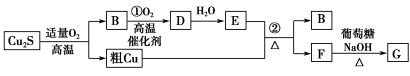
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
-
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ•mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ•mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=________.
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)⇌2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H________O(填“>”或“<”).反应进行到状态D时,v正________v逆(填“>”、“<”或“=”).
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol•L-1,则0~10min内的平均反应速率v(SO2)=________,该温度下反应的平衡常数K=________.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)________
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是________
A.向容器中通入少量O2 B.向容器中通入少量SO2C.使用催化剂 D.升高温度E.恒容通入少量氦气
⑤气体SO2是大气污染物,可选用下列试剂中的________吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
-
下列各种方法中,不适用于炼制相应金属的是
A.加热氧化汞冶炼汞 B.电解熔融氯化钠冶炼钠
C.煅烧辉铜矿(主要成分Cu2S)冶炼铜 D.氧化镁跟铝粉共热冶炼镁
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
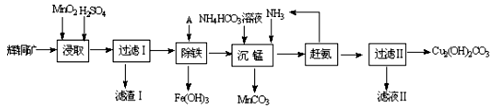
①浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2和 (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。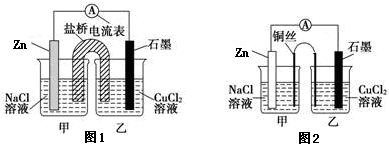
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___(填“减小”、“增大”或“不变”) ,乙池中石墨为_____极(填“正”、“负”、“阴”或“阳”) 。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
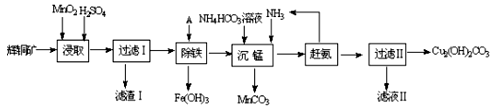
①浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2和 (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为 mol/L。(已知Ksp[Fe(OH)3]= 4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_____ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m= g。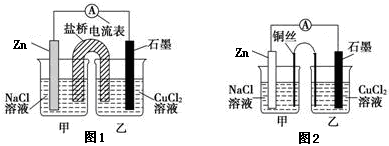
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___(填“减小”、“增大”或“不变”) ,乙池中石墨为_____极(填“正”、“负”、“阴”或“阳”) 。
-
铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
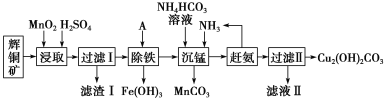
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
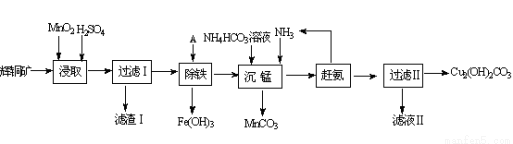
①浸取反应中氧化剂的化学式为________ ;滤渣Ⅰ的成分为MnO2、S和___________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式_________________________ 。
④滤液Ⅱ经蒸发结晶得到的盐主要是______________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则电解过程中盐桥中Cl-移向______________(填“甲池”或“乙池”)
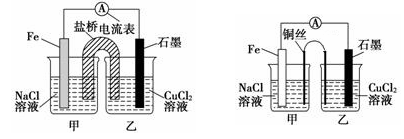
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)。
-
赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑,下列对于该反应的说法正确的是( )
A. 该反应中的氧化剂只有Cu2O B. Cu既是氧化产物又是还原产物
C. Cu2S在反应中只做还原剂 D. 氧化产物与还原产物的物质的量之比为1:6


Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。










