-
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每轨道中的电子总数相同;D原子核外成对电子数为未成对电子数的3倍;F位于第四周期d区,最高能级的原子轨道内只有2个未成对电子;E的一种氧化物具有磁性。
(1)E基态原子的价层电子排布式为__________________。第二周期基态原子未成对电子数与F相同且电负性最小的元素名称为____________。
(2)CD3- 的空间构型为_______________。
(3)A、B、D三元素组成的一种化合物X是家庭装修材料中常含有的一种有害气体,X分子中的中心原子采用_____________杂化。
(4)F(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。根据等电子原理,B、D 分子内σ键与π键的个数之比为______________。
(5)一种EF的合金晶体具有面心立方最密堆积的结构。在晶胞中,F位于顶点,E位于面心,该合金中EF的原子个数之比为_________________。若晶胞边长a pm,则合金密度为______________g·cm3(列式表达,不计算)。
-
〔化学—选修3:物质结构与性质〕(15分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32 -离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。
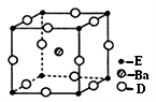
纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
-
(14分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为____,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示

该化合物的化学式为 。纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
-
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4) D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。
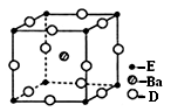
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
-
 、
、 、
、 、
、 、
、 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:① 位于周期表中第四周期
位于周期表中第四周期 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:② 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③ 原子核外
原子核外 层电子数为奇数;④
层电子数为奇数;④ 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤ 原子
原子 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
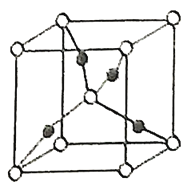
(2)在1个由 与
与 形成的
形成的 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中, 的空轨道接受
的空轨道接受 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下 、
、 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质 是__________(写名称),
是__________(写名称), 物质分子中
物质分子中 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________, 分子中
分子中 键的数目为__________
键的数目为__________ 。
。
(5) 、
、 、
、 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
-
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ________________________________________________________________________________;
(2)C、D、E的第一电离能由大到小的顺序是: ________________________________
(3)下列有关上述元素的说法中,不正确的是 ________________________________________________(填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 ________________________ 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ________________________________________________________________________;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“•”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为________________________________________________________________________ 。

-
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
(1)化合物M的结构简式为________.
(2)在元素周期表中,E元素位于第________周期________族.用电子排布式写出E元素基态原子的价电子构型________.
(3)元素C与D的第一电离能的大小关系是C________D(填“>”、“<”或“=”).
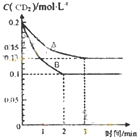
(4)在一密闭容器中发生反应2CD2(g)⇌2CD(g)+D2(g)△H>O,反应过程中CD2的浓度随时间变化的情况如图所示.
①依曲线A,反应在3min内D2的平均反应速率为________.
②若曲线A、B分别表示该反应在某不同条件下的反应情况,则此条件是________(填“浓度”、“压强”、“温度”或“催化剂”).
③曲线A、B分别对应的反应平衡常数大小关系是KA________KB(填“>”、“<”或“=”)
(5)甲同学用图1所示装置对E元素单质与浓硫酸的反应进行实验.①检查装置气密性后,将过量的E元素单质和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时.t1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变.甲同学将收集到的气体体积与时间的关系粗略地表示为图2.在0~t1时间段,E表面没有气泡生成,说明E在浓硫酸中发生了________;t1~t2时间段,反应生成的气体是________.写出开始加热时发生反应的化学方程式________.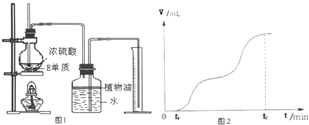
-
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面。A、B两种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是________(填字母)。
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
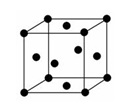
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:____________,E原子的配位数为:____________。
(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式________,________。
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是________、________。两者沸点的关系为XY(>,或<),原因是________。
-
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示
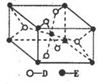
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。

①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。
-
(16分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相 同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为_______。
(2)A、B、C、D四种元素中电负性大小顺序的是__________________。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为_______________。
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示

②已知:Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol;
2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:_________。
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g) == 2CA3(g) ΔH<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。

①试比较K1, K2的大小,K1________K2(填写“ > ”、“ = ”或“ < ”)。
②在40 0 0C时,当测得CA3 和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的v(C2)正____v(C2)逆(填写“>”、“= ”或“ < ”)。











