-
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为_____mol/L。
高二化学实验题中等难度题查看答案及解析
-
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为________mol/L。
高二化学实验题中等难度题查看答案及解析
-
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+===2Mn2++CO2↑+8H2O。
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(50 mL) D锥形瓶 E烧杯
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)滴定终点的现象为__________________________。
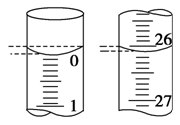
(4)若滴定开始和结束时,滴定管中的液面下图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数
待测H2C2O4溶液的体积/mL
0.1000 mol·L-1 KMnO4的体积/mL
滴定前刻度
滴定后刻度
溶液体积/mL
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
依据上表数据列式计算该H2C2O4溶液的物质的量浓度_________。
(6) 下列操作中可能使测定结果偏低的是________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
高二化学实验题困难题查看答案及解析
-
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
回答下列问题:
(1)用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液;
(2)该滴定实验选用何种指示剂,说明理由____________________(如无需加入指示剂也请说明理由);
(3)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
高二化学填空题简单题查看答案及解析
-
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(10 mL) D锥形瓶 E铁架台 F滴定管夹 G烧杯 H白纸 I胶头滴管 J漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)选何种指示剂,说明理由_____________________。
高二化学填空题困难题查看答案及解析
-
氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.01 mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4-+5HSO3-+H+
2Mn2++5SO42-+3H2O。填空回答问题:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________________
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因:
(3)选何种指示剂,说明理由 ,到达终点时颜色变化
(4)当用酸滴定碱时,下列操作使测定结果(碱的浓度)偏高的是
① 酸式滴定管滴至终点,俯视读数
② 碱液移入锥形瓶后,加入10mL蒸馏水
③ 酸式滴定管注入酸溶液后,尖嘴有气泡时便开始滴定,滴定后无气泡
④ 酸式滴定管用蒸馏水润洗后,未用标准液润洗
(5)有关数据记录如下:
实验序号
待测液体积(mL)
所消耗KMnO4酸性溶液的体积(mL)
滴定前
滴定后
1
20.00
0.50
20.60
2
20.00
6.00
25.90
3
20.00
1.40
24.20
则NaHSO3溶液的物质的量浓度为______________mol/L。
高二化学实验题困难题查看答案及解析
-
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO4﹣+5HSO3﹣+H+===2Mn2++5SO42﹣+3H2O填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A.酸式滴定管(50 mL)
B.碱式滴定管(50 mL)
C.量筒(10mL)
D.锥形瓶
E.铁架台
F.滴定管夹
G.烧杯
H.白纸
I.胶头滴管
J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因_______________。
(3)指示剂 _______ (填“需要”或“不需要”)选用,说明理由_______________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
高二化学实验题困难题查看答案及解析
-
(8分)氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液,反应离子方程式是2MnO4- + 5HSO3- + H+ ==2Mn2+ + 5SO42- + 3H2O 填空回答问题:
(1)该滴定实验所需仪器有下列中的______________________________(填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)滴定前平视KMnO4溶液,刻度为a mL,若滴定后(终点)俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积_________( 多、少)。根据(b-a)mL计算得到的待测液浓度比实际的浓度_________(大、小)。
高二化学实验题中等难度题查看答案及解析
-
滴定实验是化学学科中重要的定量实验,氧化还原滴定实验与酸碱中和滴定类似。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
(1)写出KMnO4溶液滴定H2C2O4溶液的离子方程式______________________________________;滴定时,KMnO4溶液应装在______(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________。
(2)下列操作会导致测定结果偏低的是_________。
A.滴定管在装液前未用标准KMnO4溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(3)计算:血液中含钙离子的浓度为_________mol/L。
高二化学实验题中等难度题查看答案及解析
-
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.0010 mol·L−1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液,反应的离子方程式为2
+5
+H+=2Mn2++5
+3H2O。请完成下列问题:
(1)该实验除了滴定管(50 mL)、铁架台、滴定管夹、烧杯 、白纸等仪器和用品外,还必须使用的仪器是____________。
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,根据(b−a) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
高二化学实验题困难题查看答案及解析