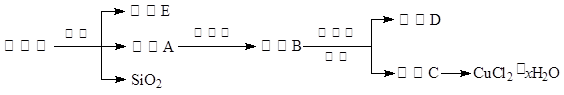-
(18分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
-
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
-
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:___。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②海水中加熟石灰;③加盐酸;④过滤;⑤蒸发浓缩冷却结晶。其步骤先后顺序是___(步骤可重复使用),
(3)上述步骤①中“一定条件下”具体是指:___,其目的是___。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥___mol·L−1。
(5)将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解溶液变澄清。反应原理可能有两方面,请分别用离子方程式表示:
①____;
②____。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取___代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。其工作时正极的电极反应式:___;用此镁电池给铅蓄电池充电,下列说法中正确的是___。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24gMg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
-
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II.将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV.TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。

②如实验IV中,应将TiO2.xH2O放在_______(填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2→2O b.O+H2O→2OH(羟基) c.OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
MnO + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+
②滴定时,将高锰酸钾标准溶液注入酸式滴定管中。滴定到达终点的现象是_________________。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。
④重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。(用分数表示)
-
(14分,每空2分) 硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)=FeSO4+H2↑、FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为 1。
1。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答) 。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
-
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。如下图所示,下列叙述正确的是( )
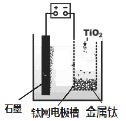
A.阳极产生的气体为氟气
B.阳极区放出的气体一定只有纯氧气
C.TiO2在阴极表面放电
D.制备金属钛前后,CaO的总量不变
-
由SiO2制备高纯度硅的工业流程如图所示:

下列说法错误的是
A.SiO2与纯硅都是硬度大、熔沸点高的晶体
B.X为CO气体
C.反应②产生的H2与反应③产生的HCl可以循环使用
D.反应①②③均为在高温条件下的非氧化还原反应
-
由SiO2制备高纯度硅的工业流程如图所示:
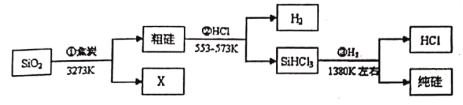
下列说法错误的是
A.SiO2与纯硅都是硬度大、熔沸点高的晶体
B.X为CO气体
C.反应②产生的H2与反应③产生的HCl可以循环使用
D.反应①②③均为在高温条件下的非氧化还原反应
-
制备单质硅的主要化学反应如下:
①SiO2+2C i+2CO↑ ②Si+2Cl2 SiCl4
i+2CO↑ ②Si+2Cl2 SiCl4 ③SiCl4+2H2
③SiCl4+2H2 Si+4HCl
Si+4HCl
下列对上述三个反应的叙述中,错误的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.三个反应的反应物中硅元素均被氧化
D.①是工业上制粗硅的反应,②③是粗硅提纯的反应
-
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
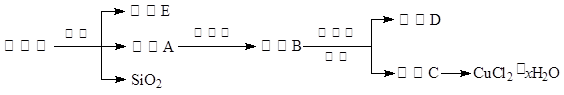
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
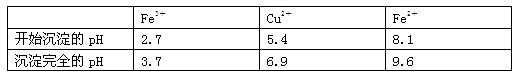
⑴酸溶时,为了提高浸取率可采取的措施有________。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式:________。
⑶加入试剂②的目的是调节pH至a,a的范围是________;
为避免引入杂质离子,试剂②可选用________。
A.氨水 B.氧化铜 C.氢氧化铜 D.氢氧化钠
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是:________。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为________mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:________。
下: