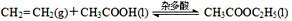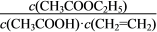-
醋酸由于成本较低,在生产中被广泛应用。
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H= - 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H= - 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度 )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:

下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
D.体系中乙烯的百分含量一定
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
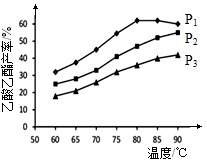
温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用 (P1)、
(P1)、 (P2)、
(P2)、 (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。
-
乙酸是重要的化工原料,在生活、生产中被广泛应用。
(1)写出乙酸在水溶液中的电离方程式_______________________。若某温度下,CH3COOH(aq)与NaOH(aq)反应的焓变△H= - 46.8kJ·mol-1 ,HCl(aq)与NaOH(aq)反应的焓变△H= - 55.6 kJ·mol-1,则CH3COOH在水中电离的焓变△H=_________kJ·mol-1。
(2)已知常温下CH3COOH的电离常数K=1.6×10-5,该温度下,1 mol·L-1CH3COONa溶液pH约为________(已知lg2=0.3)。向pH=2的CH3COOH溶液中加入pH=2的稀硫酸溶液,保持溶液温度不变,溶液的pH将________________填“变大”或“变小”或“不变”)。
(3)常温下,向10 mL 0.1 mol·L-1的CH3COOH溶液中逐滴滴入0.1 mol·L-1的ROH溶液,所得溶液pH及导电性变化如图。下列分析正确的是_______。
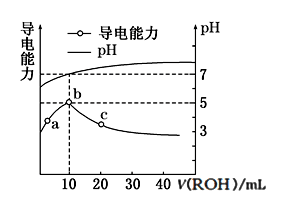
b点导电能力最强,说明ROH为强碱
b点溶液pH=5,此时酸碱恰好中和
C.c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)·c(OH-)=KW=1.0×10-14
(4)近年来用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,具有明显经济优势。其合成的基本反应如下: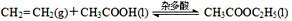
①在恒温恒容容器中投入一定量的乙烯和足量的乙酸,下列分析正确的是________。
A.当乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol,说明反应已达到化学平衡
B.当体系中乙烯的百分含量保持不变,说明反应已达到化学平衡
C.达到化学平衡后再通入少量乙烯,再次达到化学平衡时,乙烯的浓度与原平衡相等
D.该反应的平衡常数表达式为K=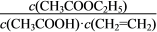
②乙烯与乙酸等物质的量投料条件下,某研究小组在不同压强下进行了在相同时间点乙酸 乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
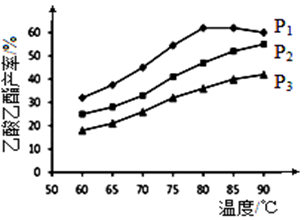
温度在60~80℃范围内,乙烯与乙酸反应速率由大到小的顺序是__________________[用 (P1)、
(P1)、 (P2)、
(P2)、 (P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
(P3)分别表示不同压强下的反应速率]。在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________________________。根据测定实验结果分析,较适宜的生产条件是_________________(填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有___________________(任写出一条)。
-
铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是______.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是______.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降除去,其原因是______.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是______.
3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是______.
-
铁单质及其化合物在生活、生产中应用广泛.请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是______.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是______.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降除去,其原因是______.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是______.
3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是______.
-
氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式____。
(2)实验室常用MnO2与浓盐酸反应制备Cl2,装置如图所示:
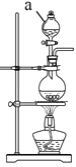
仪器a的名称为____。制备实验开始时,先检査装置气密性,接下来的操作依次是____(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图所示装置:
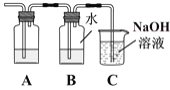
①装置A中应加入的试剂是____。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是____,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是____。
A.AgNO3溶液 B.石蕊试液 C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是____。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法____。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
-
大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“苏氏三兄弟”,它们在生活、生产中有广泛应用。
(1)工业上制备苏打是先制备小苏打,写出我国伟大化学家侯德榜提出的制备小苏打的化学方程式___,操作时,往饱和食盐水中先通入气体,先制备小苏打的原因是___。
(2)Na2S2O3标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因__。
(3)工业上,常用纯碱和盐酸除去锅炉中硫酸钙。先用饱和纯碱溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是__。
(4)工业上,将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。写出该反应的化学方程式__。Na2S溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式为__。
(5)在密闭容器中投入一定量的Na2O2和NaHCO3,在300℃下充分反应。若残留固体为纯净物,则起始时 满足的条件是__。
满足的条件是__。
-
铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)  c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
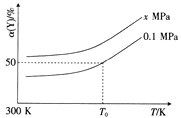
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
-
铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)  c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
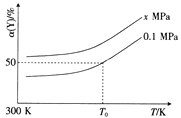
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
-
铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g)  c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
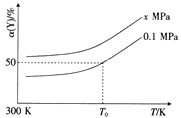
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
-
铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为______.
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是______.
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是______.
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO═3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移电子的物质的量是______.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是______(填字母).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的
金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应
生成氢气 | 高温下氢气能还原氧化
铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形
成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
)

(P1)、
(P2)、
(P3)分别表示不同压强下的反应速率],分析其原因为 。