-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
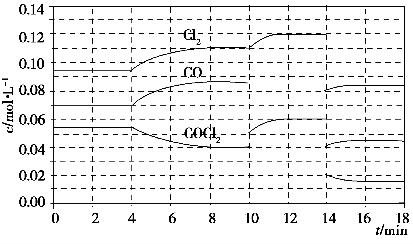
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
已知COCl2(g)  Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
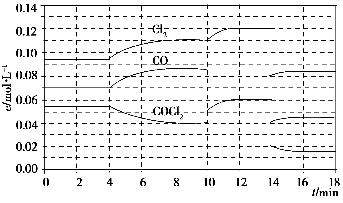
(1)化学平衡常数表达式K=________,计算反应在第8 min时的平衡常数K=________;
(2)比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
(3)若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________;10~12 min内CO的平均反应速率为v(CO)=________;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率(平均反应速率分别以v(2~3)、v(5~6)、v(12~13))的大小________________。
-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
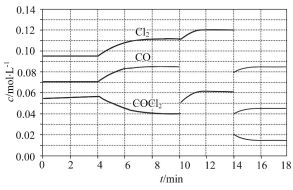
①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2 min~3 min、5 min~6 min和12 min~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小 ;
⑤比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6) v(15~16)(填“<”、“>”或“=”),原因是 。
(2)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断 (NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a、NH4HCO3 b、NH4A c、(NH4)2CO3 d、NH4Cl
-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)氯气工业上来源于氯碱工业,氯碱工业的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则该反应的热化学方程式为:__________________;
(3)COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
Cl2(g) + CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
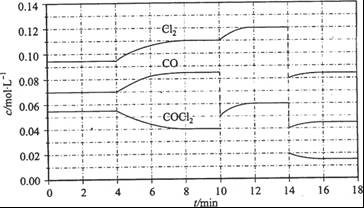
①计算反应在第8 min时的平衡常数K = __________(保留小数点后两位数字)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、 “>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以V(2—3)、 V(5—6)、 V(l2-13)表示]的大小____________;
⑤反应物COCl2在5-6 min和15-16 min时平均反应速率的大小为:V(5-6) > V(15-16),原因是_______________________。
-
(14分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为: ;
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为__ ;
(3)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H = +108 kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
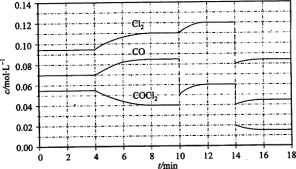
①计算反应在第8 min时的平衡常数K = __________(保留小数点后三位)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
-
(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
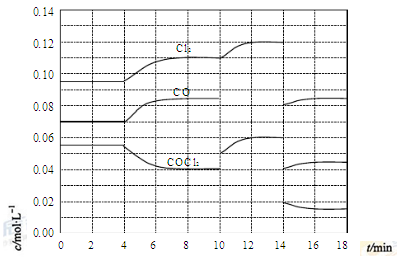
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
-
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):

①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小:v(5−6)
v(15−16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)
-
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用CO与Cl2在活性炭催化下合成.
(1)实验室中常用来制备氯气的化学方程式为________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1、-283.0kJ•mol-1,则生成1m3(标准状况)CO所需热量为________;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g)△H=+108kJ•mol-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的浓度变化曲线未示出):
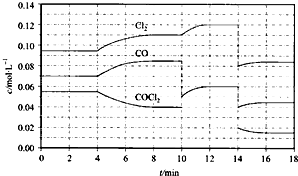
①计算反应在第8min时的平衡常数K=________;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)________T(8)(填“>”、“<”或“=”)
③若12min时反应于T(8)下重新达到平衡,则此时c(COCl2)=________mol•L-1
④比较产物CO在2~3min、5~6min、12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小________;
⑤比较反应物COCl2在5~6min、15~16min时平均反应速率的大小:v(5~6)________v(15~16)(填“>”、“<”或“=”),原因是________.
-
工业上采用高温活性炭催化CO与C12合成光气(COCl2))。
(1)COCl2 中的原子最外层都达到 8电子稳定结构,光气分子的电子式为_____。
(2)工业上利用天然气(CH4)与CO2 进行高温重整制备CO的反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.3 kJ/mol。已知:C—H、C≡O、H—H键的键能依次为413 kJ·mol-1、1076 kJ·mol-1、436 kJ·mol-1,则 C=O键的键能为____kJ·mol-1。
(3)光气为窒息性毒剂,极易水解生成氯化氢,泄露后可用水雾吸收,化学方程式为:_______。
(4)某温度下,在2L恒容密闭容器中充入 2 mol CO(g)、2 mol Cl2(g)和适量的活性炭,发生反应:Cl2(g)+CO(g) COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
COCl2(g) ΔH=-108 kJ·mol-1,测得在混合气中COCl2的体积分数φ(COCl2)和时间t 的关系如图曲线Ⅰ所示。
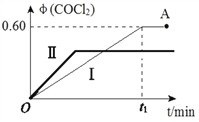
①下列情况不能表明该反应达到平衡状态的是_______(填字母标号)。
A.CO的体积分数不改变
B.Cl2的消耗速率与COCl2的生成速率相等
C.体系中 不改变
不改变
D.混合气体的平均相对分子质量不再变化
②按曲线Ⅰ,平衡常数K=____。A点时,向容器中加入等物质的量CO和Cl2,再次达到平衡时,光气的体积分数会 ______(填“增大”、 “减小”或“不变”。
③曲线Ⅱ相对曲线Ⅰ改变的条件可能是_______(填字母标号)。
A.恒容通入惰性气体 B.通入 CO
C.增大压强 D.升高温度
-
CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
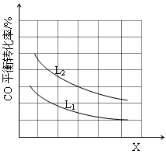
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g)  COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0. 90 | |
| 2 | 0.80 | |
| 4 | | 0.20 |
①反应0~2min末的平均速率v(COCl2)=__________mol/(L∙min)。
②在2min~4min间,v(Cl2)正___________v(Cl2)逆 (填“>”、“=”或“<”),该温度下K =_________。
③已知X、L可分别代表温度或压强,右图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是___________;a_______0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体,
2CO(g)+2NO(g)  2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 。
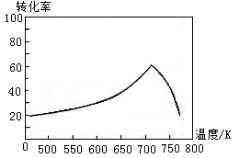
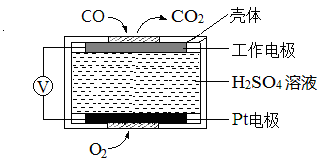
图1 图2
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为 ;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式 。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)  CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。











