-
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH==2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
实验步骤
实验现象及相关结论
①取少量电解质溶液于试管中,用pH试纸测其pH。
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。
②继续加入( )溶液,再加入( )溶液,振荡。
若有白色沉淀产生,则溶液中含有K2SO4。
若无白色沉淀产生,则溶液中没有K2SO4
③另取少量电解质溶液于试管中,先加1 mol·L-1 的H2SO4酸化,再滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡
( )
(5)若电池开始工作时每100mL电解质溶液含KOH 56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度( )。
(结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
高二化学简答题极难题查看答案及解析
-
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为 。
②不能用燃烧的方法处理尾气H2S气体的理由是 。
(2)用30%FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S=S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显 (填字母)。
A.不稳定性 B.弱酸性 C.氧化性 D.还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是 。
(3)在Fe(OH)3胶体中逐滴加入HI稀溶液,会出现一系列变化:
①先出现红褐色沉淀,原因是: ;
②随后沉淀溶解,溶液呈黄色,写出此过程反应的离子方程式: ;
③最后溶液颜色加深或黄褐色,用离子方程式表示该过程: ;
高二化学填空题简单题查看答案及解析
-
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.如图是一个电化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为______.
(2)充电时:①原电池的负极与电源______极相连.②阳极的电极反应为______.
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗O2______L(标准状况下).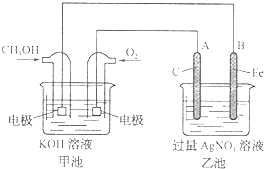
高二化学解答题中等难度题查看答案及解析
-
甲烷燃料电池是使用气体燃料和氧气直接反应产生电能,一种很有前途的能源利用方式,它的优势在于________.KOH溶液为介质的甲烷燃料电池中,甲烷为________极,空气极的电极反应式为:O2+2H2O+4e-=4OH-,则甲烷极的电极反应式________.

高二化学填空题中等难度题查看答案及解析
-
可以将氧化还原反应2H2+O2
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通的气体应是 ,正极通的气体就是 ,电极反应为:正极 ,负极 。
(2)如果把KOH改为稀硫酸作电解质,则电极反应为:正极: ,负极: 。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化? 。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应为:正极: ,负极: 。
高二化学填空题中等难度题查看答案及解析
-
硫化氢裂解制取氢气的反应为2H2S(g)
2H2(g)+S2(g)。向恒容密闭容器中充入一定量的H2S气体,测得体系中气体的平衡组成与温度的关系如图所示。下列说法正确的是

A. 该反应平衡常数随温度升高而增大
B. M点时容器内气体总压强比N的大
C. M点时,H2S的平衡转化率为50%
D. 维持M点温度不变,向容器中再充入0.2molH2S、0.2molH2、0.1molS2(g),则v(正) = v(逆)
高二化学多选题中等难度题查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O。则下列说法正确的是( )
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-+H2O===CO2↑+6H+
C.由于CO水解显碱性,电池放电时,电解质溶液的pH逐渐增大
D.电池放电时每消耗1 mol CH3OH转移6 mol电子
高二化学选择题中等难度题查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为2CH3OH+3O2+4OH-===2CO32-+6H2O。则下列说法正确的是 ( )
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-+H2O===CO2↑+6H+
C.由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大
D.电池放电时每消耗1 mol CH3OH转移6 mol电子
高二化学单选题中等难度题查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为2CH3OH+3O2+4OH-===2CO32-+6H2O。则下列说法正确的是 ( )
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-+H2O===CO2↑+6H+
C.由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大
D.电池放电时每消耗1 mol CH3OH转移6 mol电子
高二化学选择题中等难度题查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO
+6H2O.则下列说法正确的是
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+
C.由于CO
水解显碱性,电池放电时,电解质溶液的pH逐渐增大
D.电池放电时每消耗1m
olCH3OH转移6mol电子
高二化学选择题困难题查看答案及解析