-
水合草酸亚铁(FeC2O4·xH2O)在制药工业上有广泛应用。以莫尔盐[(NH4)2SO4·FeSO4·6H2O]为原料制备FeC2O4·xH2O,并探究其性质。回答下列问题:
已知:草酸亚铁晶体为淡黄色粉末,难溶于水,溶于稀酸;pH>4时,Fe2+容易被氧化。
I.制备FeC2O4·xH2O(如图)
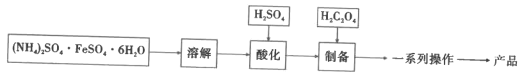
(1)加入H2SO4的目的是__。
(2)制备步骤的离子方程式是__。
(3)一系列操作是__。
II.探究FeC2O4·xH2O的分解产物:CO2、CO(如图)
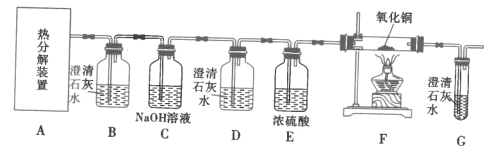
(4)装置D的作用是__,证明分解产物中存在CO的现象是__。
(5)从绿色化学角度考虑,实验存在不足之处,指出并提出解决方案:__。
III.定量测定FeC2O4·xH2O的化学式[M(FeC2O4)=144]
操作步骤:准确称取mg草酸亚铁晶体,溶于V1mL、c1mol·L-1的H2SO4溶液中,加热,用KMnO4标准溶液滴定至终点,加入锌粉将Fe3+恰好全部还原为Fe2+,然后用c2mol·L-1KMnO4标准溶液滴定至终点,记录消耗KMnO4标准溶液的体积为V2mL。
(6)第二次使用KMnO4标准溶液滴定的离子方程式为__。
(7)x=_(用字母表示)。
-
(16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:
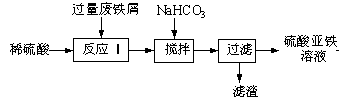
回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL• L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol•L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol•L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式: MnO4-+ Fe2++ H+—— Mn2++ Fe3++ H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol•L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL• L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g• mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
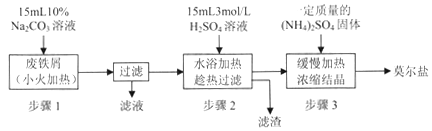
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
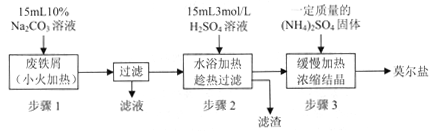
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
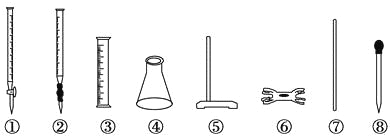
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。

A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
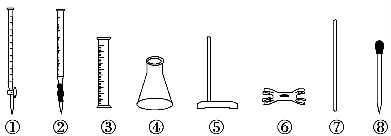
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
工业上利用某合金废料(含铁、铜、碳)为原料制备CuSO4和(NH4)2SO4•FeSO4•6H2O(莫尔盐)的工艺流程如下:
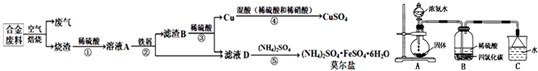
回答下列问题:
(1)实验室用容量瓶配制一定物质的量浓度的稀硫酸,定容时若俯视刻度线,则会导致配制的溶液浓度______(填“偏大”、“偏小”或“无影响”).
(2)步骤②和步骤③中会产生同一种气体,生成该气体的离子方程式为:______.
(3)用Cu和混酸(稀硫酸、稀硝酸)制备CuSO4溶液时,为得到纯净的CuSO4溶液,混酸中硫酸和硝酸的浓度之比最好为______.
(4)浓度均为0.1mol•L-1的莫尔盐溶液和(NH4)2SO4溶液中,c(NH4+)前者大于后者,原因是______.
(5)莫尔盐比绿矾更稳定,常用于定量分析.利用莫尔盐溶液可将酸性KMnO4还原为Mn2+,反应的离子方程式为:______.
(6)某化学兴趣小组设计用如图所示装置制备(NH4)2SO4溶液.
①装置A圆底烧瓶中的固体试剂为______(填试剂名称).
②将装置B中两种液体分离开,所需的最主要的玻璃仪器为______(填仪器名称).
③装置C的作用为______.
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
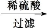 溶液A
溶液A

 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+的最佳试剂是 (填序号字母)。
A.酚酞溶液 B.KSCN溶液
C.烧碱溶液 D.KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、 、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质;② 。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 。
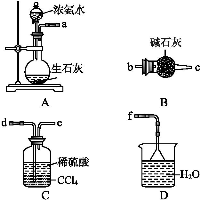
将装置C中两种液体分离开的操作名称是 。装置D的作用是 。
-
浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑
 溶液A
溶液A

 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
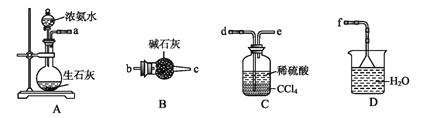
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。









 溶液A
溶液A

