-
PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
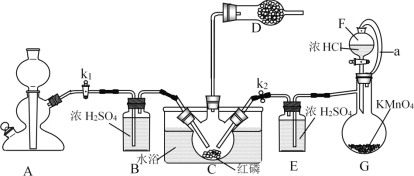
经查阅资料知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
回答下列问题:
(1)仪器G的名称是______。装置F与G由橡胶管a相连通,a的作用是_______。
(2)A是制取CO2装置,CO2的作用是_____,选择A中的药品是_____(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)装置D中盛有碱石灰,其作用是__________________。
(4)装置G中生成Cl2,反应的离子方程式为___________。
(5)装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5,然后通过___________(填实验操作名称),即可得到较纯净的PCl3。
(6)通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 5mol•L-1碘溶液20 mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 mol•L-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12mL。
①第三步中反应的化学方程式为_____________。
②根据上述数据,计算该产品中PCl3的质量分数为______%。
-
PCl3是制造有机磷农药和磺胺嘧啶类医药的原料,其制备方法是将熔融黄磷(P4)与干燥氯气进行氯化反应。
(1) PCl3遇水会强烈水解,写出PCl3与水反应的化学方程式:________。
(2) 制得的PCl3粗产品中常含有POCl3、PCl5等杂质。通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
a. 迅速移取20.00 g PCl3粗产品,加水完全水解后,再配成500.00 mL溶液;
b. 量取所配溶液25.00 mL于碘量瓶中,加入0.500 0 mol·L-1碘溶液20.00 mL和1.000 mol·L-1(NH4)3BO3溶液30.00 mL,振荡;
c. 加入2~3滴淀粉溶液,用1.000 0 mol·L-1 Na2S2O3标准溶液滴定过量的碘,滴至终点时消耗Na2S2O3标准溶液12.00 mL。
已知测定过程中的部分反应为H3PO3+H2O+I2 H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
①步骤b中加入(NH4)3BO3溶液的目的是________。
②判断步骤c中滴定终点的方法为________。
③根据上述数据,计算制得粗产品中PCl3的质量分数(写出计算过程)。_________
-
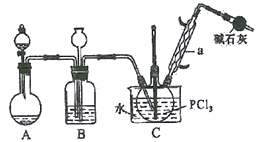
三氯氧磷(POCl3) 俗名磷酰氯、氧氯化磷,是重要的基础化工原料,可用于制取染料、农药,有机合成的氯化剂、催化剂和阻燃剂等。某化学实验小组模拟PCl3直接氧化法制备POCl3,其实验装置设计如下:
有关物质的部分性质如下表:
| 熔点/℃ | 沸点/℃ | 其他 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是__________,装置A中发生反应的化学方程式为__________________。
(2)B中所装试剂为__________,B装置的作用除观察O2的流速之外,还有_____________________。
(3)C装置控制反应在60℃~65℃进行,其控温的主要目的是__________。
(4) 实验制得的POCl3粗产品中常含有PCl3,可用__________方法提纯。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖,以防止在滴加NH4SCN 时,将AgCl沉淀转化为AgSCN沉淀。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知: Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是__________ (填标号)。
a.FeCl2 b.甲基橙 c.淀粉 d.NH4Fe(SO4)2
②Cl元素的质量百分含量为__________ (列出算式)。
③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl-元素含量将会__________ (填“偏大”“偏小”或“不变”)。
-
亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
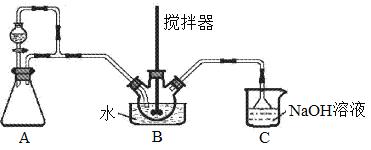
(1)装置A制取SO2,反应的化学方程式为___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置B应该使用的是___(填“冷水”或“温水”)浴。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是__。
(3)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(4)测定亚硝酰硫酸的纯度:
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为__。
③亚硝酰硫酸的纯度=__。[M(NOSO4H)=127g·mol-1]
-
亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
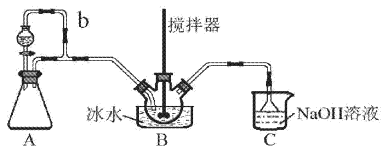
(1)装置A制取SO2
①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。(精确到0.1%)[M(NOSO4H)=127g·mol-1]
-
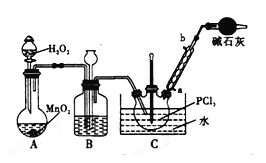
POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:
资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POC13 | 2.0 | 106.0 | 153.5 |
(1)B中所盛的试剂是________,干燥管的作用是_____________________。
(2)POC13遇水反应的化学方程式为____________________________。
(3)装置B的作用除干燥O2外,还有_____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是__________________________。
(6)步骤④中X为____________________ 。
(7)反应中POC13的百分含量为_________,通过__________(填操作)可以提高产品的纯度。
-
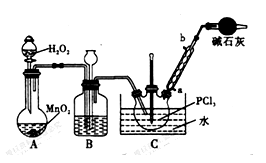
POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:
资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POC13 | 2.0 | 106.0 | 153.5 |
(1)B中所盛的试剂是________,干燥管的作用是_____________________。
(2)POC13遇水反应的化学方程式为____________________________。
(3)装置B的作用除干燥O2外,还有_____________________________。
(4)反应温度要控制在60~65℃,原因是:____________________________。
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是__________________________。
(6)步骤④中X为____________________ 。
(7)反应中POC13的百分含量为_________,通过__________(填操作)可以提高产品的纯度。
-
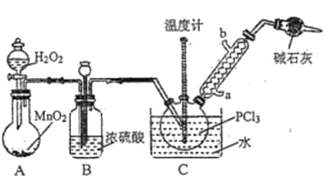
三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)> Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3遇水反应的化学方程式为_________________________________________。
(2)装置B的作用除干燥O2外,还有_________________________________________。干燥管的作用是_______________。
(3)反应温度要控制在60~65℃,原因是_____________________________________________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________。若无此操作,所测产品中氯元素的质量分数将会__________(填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________, 产品中POCl3的质量分数为____________。
-
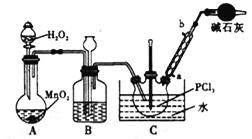
POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。
-
三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
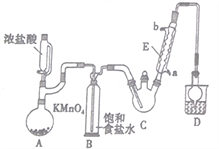
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器E的名称是____________,冷凝水的流向是________进_______出(填“a”或“b”)。
(2)该设计流程中存在一处缺陷,该缺陷是__________, 引起的后果是_________________。
(3)仪器A中发生反应的离子方程式为____________________。
(4)该装置C可采用_______________,加热的方法以控制反应温度在70 ℃左右。
(5)装置D干燥管的作用为_______________, 装置 D烧杯中的试剂是_______________。
(6)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是____________(填名称)。
(7)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol·L-1,Ka(CH3COOH)=1.7×10-5mol·L-1,请设计实验证明三氯乙酸、乙酸的酸性强弱:____________________________。








