-
Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
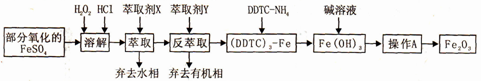
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
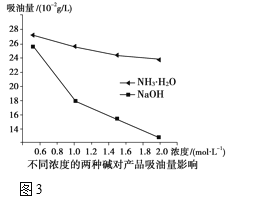
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。

(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
-
Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如图1。
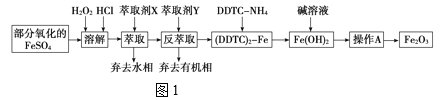
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离;
②3DDTCNH4+Fe3+===(DDTC)3Fe↓+3NH4+。
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是______________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图2用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图3所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为__________。
(4)操作A的步骤包括___________________________________________。
(5)现准确称取4.000 g样品,经酸溶、还原为Fe2+,在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.100 0 mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL。
①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为______________
②产品中铁的含量为___________(假设杂质不与K2Cr2O7反应)。
-
某化学小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁(Fe2O3),并进行铁含量的测定。主要操作步骤如下:
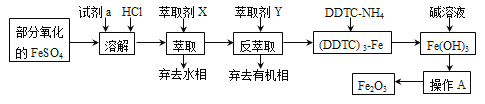
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
②3DDTC-NH4+Fe3+=(DDTC)3-Fe↓+3NH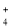 。
。
请回答下列问题:
(1)写出加入试剂a发生反应的离子方程式_________。
(2)溶液中加入萃取剂X,转移至分液漏斗中,塞上玻璃塞振摇,振摇几次后需打开分液漏斗的___放气;为提高萃取率和产品产量,实验时应进行的操作是__________。
(3)可作反萃取的萃取剂Y的最佳试剂是(填试剂名称)____。
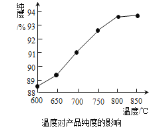
(4)操作A为_____、_____、______。产品处理时,温度对产品的纯度有很大影响。已知温度对产物纯度的影响如图所示,则温度最好控制在______℃。
(5)现准确称取4.000g样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用______(填仪器名称)移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定,消耗K2Cr2O7溶液20.60mL。产品中铁的含量为______(假设杂质不与K2Cr2O7反应)。
-
高纯氧化铁性能稳定,无毒、无臭、无味,是食品、药品、化妆品常用着色剂。 某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:

已知:试剂X是浓盐酸,HCl(浓)+FeCl3 HFeCl4
HFeCl4
请回答下列问题:
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是_________(填序号)

(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在_________ (填“水”或“有机”)相中。
②分液时,为保证液体顺利流下,应先_________,再打开旋塞,待下层液体完全流尽时,关闭悬塞后再从上口倒出上层液体。
(3)制备萃取剂Y(甲基异丁基甲酮)时,其粗产品中含有异丙叉丙酮、4-甲基-2-戌醇、酸性物质等杂质。一般可采用蒸馏法进行提纯。蒸馏时,应将温度计水银球置于_________。蒸馏前,预处理粗产品时,可以先用_________洗(填所选试剂对应的字母,下同),后用_________洗,最后用_________洗。
A水 B碳酸氢钠溶液 C乙醇
(4)下列试剂中,反萃取剂Z的最佳选择是_________,反萃取能发生的原因是_________(从化学平衡的角度进行解释)。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
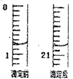
(5)测定产品中氧化铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标 准K2Cr2O7溶液滴定(还原产物是Cr3+,杂质不与K2Cr2O7反应)。现准确称取1.0g样品经酸溶、还原为Fe2+,用0.1000mol/L的标准溶液进行滴定。
①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为_________mL。
②产品中氧化铁的含量为_________(保留三位有效数字)。
(6)我国早期科技丛书《物理小识·金石类》就有煅烧青矾(又名绿矾,FeSO4·7H2O)制氧化铁的记载:“青矾厂气熏人,衣服当之易烂,载木不盛”,据此分析,写出煅烧青矾制氧化铁的化学方程式:_________。
-
高纯氧化铁性能稳定,无毒、无臭、无味,是食品、药品、化妆品常用着色剂。 某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:

已知:试剂X是浓盐酸,HCl(浓)+FeCl3 HFeCl4
HFeCl4
请回答下列问题:
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是_________(填序号)
(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在_________ (填“水”或“有机”)相中。
②分液时,为保证液体顺利流下,应先_________,再打开旋塞,待下层液体完全流尽时,关闭悬塞后再从上口倒出上层液体。
(3)制备萃取剂Y(甲基异丁基甲酮)时,其粗产品中含有异丙叉丙酮、4-甲基-2-戊醇、酸性物质等杂质。一般可采用蒸馏法进行提纯。蒸馏时,应将温度计水银球置于_________。蒸馏前,预处理粗产品时,可以先用_________洗(填所选试剂对应的字母,下同),后用_________洗,最后用_________洗。
A水 B碳酸氢钠溶液 C乙醇
(4)下列试剂中,反萃取剂Z的最佳选择是_________,反萃取能发生的原因是_________(从化学平衡的角度进行解释)。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
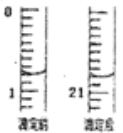
(5)测定产品中氧化铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标 准K2Cr2O7溶液滴定(还原产物是Cr3+,杂质不与K2Cr2O7反应)。现准确称取1.0g样品经酸溶、还原为Fe2+,用0.1000mol/L的标准溶液进行滴定。
①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为_________mL。
②产品中氧化铁的含量为_________(保留三位有效数字)。
-
铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
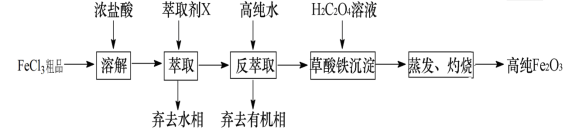
已知:HCl(浓) + FeCl3 HFeCl4 。试回答下列问题:
HFeCl4 。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式 ___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
-
铁是人类较早使用的金属之一,铁及其化合物在现代社会各个领域仍有广泛的应用。
I.氧化物—Fe2O3:用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:

已知:HCl(浓) + FeCl3 HFeCl4 。试回答下列问题:
HFeCl4 。试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
① Ca2+、Mn2+、Cu2+等杂质离子主要在__________(填“水”或“有机”)相。
② 若实验时共用萃取剂X 150mL,萃取率最高的方法是__________(填字母)。
a.一次性萃取,150mL b.分2次萃取,每次75mL c.分3次萃取,每次50mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是________________(写化学式);反萃取能发生的原因是___________________。
(3)所得草酸铁沉淀需用冰水洗涤,其目的一是洗去沉淀表面吸附的杂质离子,二是________________。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式 ___________________。
II.含氧酸盐—铁酸铜(CuFe2O4)是很有前景的热化学分解水制氢的材料,CuFe2O4在制氢过程中可以循环使用。在热化学循环分解水制氢的过程中,铁酸铜(CuFe2O4)先要煅烧成氧缺位体(CuFe2O4-a),氧缺位值(a)越大,活性越高,制氢越容易。
(5)根据以上提示,写出氧缺位体与水常温下反应制氢的化学方程式____________。
(6)课外小组将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,则氧缺位值(a)=__________。(结果保留小数点后2位)
-
(14分)用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下:
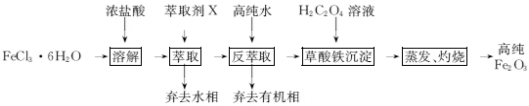
已知:HCl(浓)+FeCl3  HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在 (填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是 (填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是 (写化学式);反萃取能发生的原因是 。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是 。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目 。
-
化学实验设计和操作中必须十分重视安全问题和环保问题。下列实验方法或实验操作不正确的有几个
①在制取氧气中排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
③水和碘的四氯化碳溶液分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
④进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑤酒精着火时可用湿抹布或沙土扑火
⑥进行SO2性质实验时要在通风橱内进行,多余的SO2一律排到室外
⑦做实验时可用手直接拿取金属钠
⑧夜间发生厨房煤气泄漏,应立即开灯检查煤气泄漏的原因,并打开所有门窗通风
⑨不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
⑩用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
A.5个 B.6个 C.7个 D.8个
-
下列实验目的能实现的是(部分夹持装置已略去)( )
A. 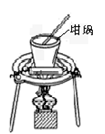 对溶液进行蒸发、浓缩、结晶
对溶液进行蒸发、浓缩、结晶
B. 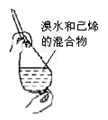 以己烯为萃取剂萃取溴水中的溴单质
以己烯为萃取剂萃取溴水中的溴单质
C. 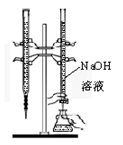 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸
用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸
D. 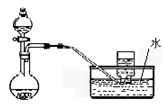 用稀硝酸与铜反应制取并收集NO
用稀硝酸与铜反应制取并收集NO

 。
。















 对溶液进行蒸发、浓缩、结晶
对溶液进行蒸发、浓缩、结晶 以己烯为萃取剂萃取溴水中的溴单质
以己烯为萃取剂萃取溴水中的溴单质 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸
用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 用稀硝酸与铜反应制取并收集NO
用稀硝酸与铜反应制取并收集NO