-
N2H4·H2O(水合肼)极毒且不稳定,100℃以上易分解失水,常用作还原剂和除氧剂(通常生成N2和H2O),其熔点为-40℃,沸点118.5℃。现以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O和无水Na2SO3,其主要流程如下:
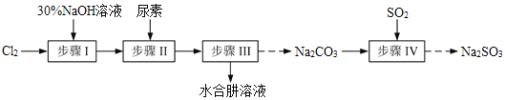
已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(aq) △H<0
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒、烧杯外,还需要_____________(填标号)。
A.容量瓶 B.胶头滴管 C.玻璃棒 D.锥形瓶
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液充分反应生成NaClO3和NaCl。实验中为控制反应温度除了用冰水浴、充分搅拌外,还需采取的措施是_______________________。
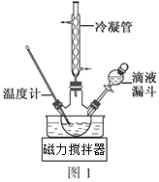
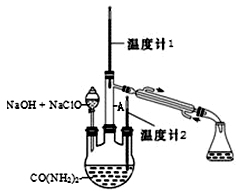
(3)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________(填字母);
a.尿素溶液 b.NaClO碱性溶液 c.尿素溶液或NaClO溶液任选其一
理由是____________________________________。
(4)步骤Ⅲ中分离出N2H4·H2O应该采用的方法最合理是____________________。
(5)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图2所示,Na2SO3的溶解度曲线如图3所示)。
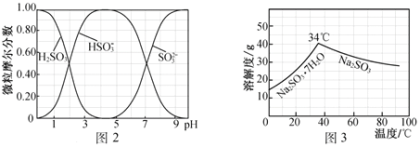
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的方法是______________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:_____________________,用少量无水乙醇洗涤,干燥,密封包装。
(6)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
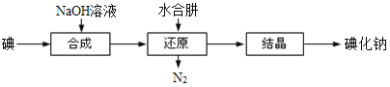
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是_______________________。
-
水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:
CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1 000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
-
水合肼(N2H4·H2O) 是一种强还原剂,沸点118.5℃,熔点-40℃,常温下为无色透明的油状液体,属于二元弱碱,在空气中可吸收CO2而产生烟雾。水合肼的制备装置如图。
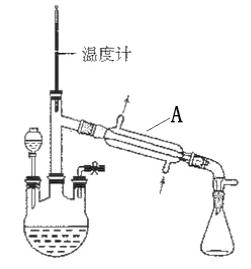
(1)装置A的名称为________________。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是______________________。
(2)水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为__________________。
(3)制备水合肼时,分液漏斗应盛装________(填标号)。理由是___________。
a.NaOH 和NaClO 混合溶液 b.CO(NH2)2 溶液
(4)弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为_____________。常温下Ksp[Cr(OH)3]= 10-32,且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=________。
(5)有同学认为该实验收集装置有缺陷。请你写出改进措施:______________。
-
碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
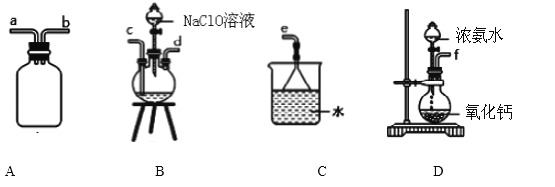
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
-
水合肼(N2H4·H2O)是无色,具有强还原性的液体,易溶于水,沸点约为118℃,实验室可用如下图所示实验装置制取水合肼。
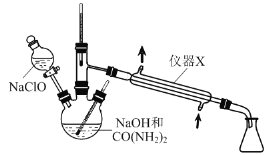
(1)仪器X的名称是:__________。
(2)制取N2H4·H2O反应中还有Na2CO3、NaCl生成。写出反应的化学方程式:__________。
(3)反应时应逐滴滴加NaClO溶液,且NaClO溶液不能过量,原因是__________。
(4)某实验小组用如下实验测定某溶液中N2H4·H2O的含量(g·L−1):
步骤1:准确量取溶液25.00 mL,向其中加入过量的浓度为0.5000 mol·L-1的I2溶液20.00 mL、一定量的H2SO4和NaHCO3,充分反应;
步骤2:向步骤1反应后的溶液中滴加少量淀粉溶液,用0.5000 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液16.00 mL。
测定过程中的反应如下:
N2H4·H2O+H2SO4+NaHCO3+I2-N2↑+CO2↑+Na2SO4+NaI+H2O(未配平)
2Na2S2O3+I2=Na2S4O6+2NaI
计算溶液中N2H4·H2O的含量(g·L−1),写出计算过程_______________。
-
水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
实验1:制备NaClO溶液。(已知:3NaClO 2NaCl+NaClO3)
2NaCl+NaClO3)
(1)如图一装置A中___(仪器名称)内发生反应的化学方程式为___。
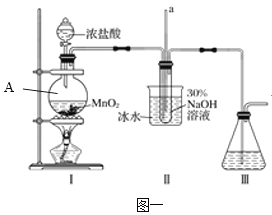
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有____(填字母)。
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是____。
实验2:制取水合肼。
(4)图二中充分反应后,___(填操作名称)A中溶液即可得到水合肼的粗产品。若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式___。
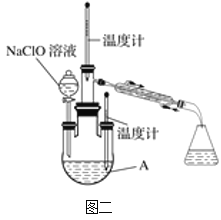
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在___(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是___(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数___。
-
水合肼(N2H4·H2O)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。
(1)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)=2NO2(g); △H=+67.7 kJ·mol-1
N2H4(g)+O(g)=N2(g)+2H2O(g); △H=-534.0 kJ·mol-1
NO2(g)= N2O4(g); △H=-28.0 kJ·mol-1
N2O4(g); △H=-28.0 kJ·mol-1
反应2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的△H=________kJ·mol-1。
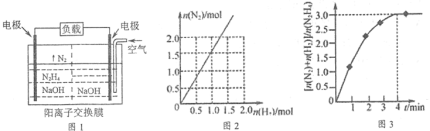
(2)目前正在研发的高能量密度燃料电池车是以水合肼燃料电池作为动力来源,电池结构如图1所示。
①起始时正极区与负极区NaOH溶液浓度相同,工作一段时间后,NaOH浓度较大的是___(填“正”或“负”)极区。
②该电池负极的电极反应式为_____________。
(3)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),0.1 mol·L-1水合肼溶液中四种离子:①H+、②OH-、③ 、④
、④ 的浓度从大到小的顺序为_________(填序号)。
的浓度从大到小的顺序为_________(填序号)。
(4)在弱酸性条件下水合肼可处理电镀废水,将 还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为___________________。
还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为___________________。
(5)肼是一种优良的贮氢材料,其在不同条件下分解方式不同。
①在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2物质的量变化如图2所示,该分解反应方程式为__________________。
②在303K,NiPt催化下,则发生N2H4(l) N2(g)+2H2(g)。在2L密闭容器中加入1 mol N2H4,测得容器中
N2(g)+2H2(g)。在2L密闭容器中加入1 mol N2H4,测得容器中 与时间关系如图3所示。则0~4 min氮气的平均速率v(N2)=____________。
与时间关系如图3所示。则0~4 min氮气的平均速率v(N2)=____________。
-
水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+ NaClO=Na2CO3+N2H4·H2O+NaCl。据此,某学生设计了下列实验。
I、制备 NaClO溶液
实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
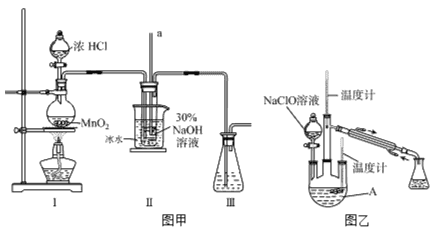
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_____________________________。
Ⅱ、制取水合肼
实验装置如上图图乙所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式________________________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(4)称取馏分0.3000g,加水配成20.0mL溶液,一定条件下用0.1500mol·L-1的I2溶液滴定。
已知:N2H4·H2O +2I2=N2↑+4HI+H2O
①滴定时,可以选用的指示剂为____________________;
②实验测得消耗I2溶液的平均值为20.00L,馏分中N2H4·H2O的质量分数为____________________。
-
通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水生成碳氧双键的结构: +H2O,且有机物R-X在碱性条件下与H2O发生反应生成R-OH(X代表Cl、Br、I),下图所示是9个化合物的转变关系。
+H2O,且有机物R-X在碱性条件下与H2O发生反应生成R-OH(X代表Cl、Br、I),下图所示是9个化合物的转变关系。
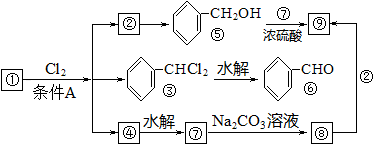
(1)化合物①的结构简式________________,它跟氯气发生反应的条件A是_______________。
(2)检验化合物⑥中官能团的化学方程式为__________________________________。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它。此反应的化学方程式为________________________________________________。
(4)已知化合物⑥与浓碱共热条件下可发生自身的氧化还原反应,即部分作还原剂被氧化,部分作氧化剂被还原,请写出此反应的化学方程式(假设所用的浓碱为浓NaOH)_________;
(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如下表
| 共价键 | Cl—H | C—H | Cl—Cl | C—Cl |
| 能量变化/kJ·mol-1 | 432 | 413 | 243 | 328 |
计算:1mol①(g) 和1molCl2(g) 反应生成1mol②(g)的热效应△H= __________ kJ·mol-1。
-
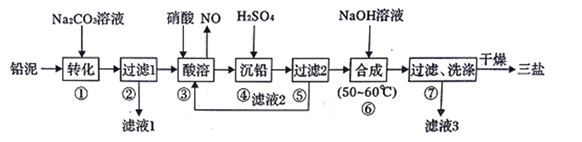
三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示
已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。













