-
据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A. 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
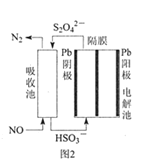
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式__。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g) 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
| n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时 =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)  CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)为探究反应X的反应速率与浓度的关系,向恒容密闭容器中通入浓度均为1.0mol•L-1的H2与CO2。恒温条件下,根据相关数据绘制出反应速率与浓度关系曲线:v正~c(CO2)和v逆~c(H2O)。则与曲线v正~c(CO2)相对应的是如图___曲线。(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线乙对应的平衡点可能为___(填字母)。
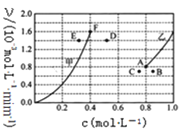
(6)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与 的关系如图所示:
的关系如图所示:
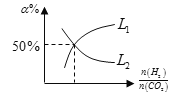
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g)=CO2(g) △H1=−393.5kJ·mol−1
2C(s)+O2(g)=2CO(g) △H2=−221.0kJ·mol−1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A. 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
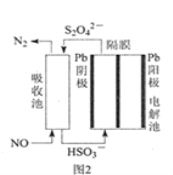
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g) 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
| n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时 =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与 的关系如图所示:
的关系如图所示:
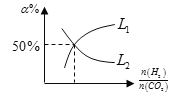
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol−1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol−1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol−1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。
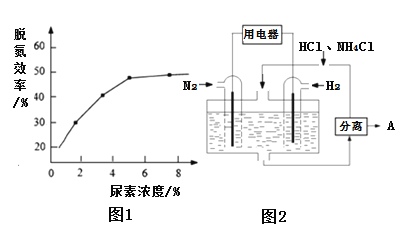
(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭 足量
足量 和NO,发生反应:
和NO,发生反应:

 △H<0,NO和
△H<0,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
(1)T1℃温度下,反应进行了 ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率 ______。已知:气体分压
______。已知:气体分压 气体总压
气体总压 体积分数。
体积分数。 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数 ______。
______。
 第
第 后,温度调整到
后,温度调整到 ,数据变化如上表所示,则
,数据变化如上表所示,则 ______
______ 填“
填“ ”“
”“ ”或“
”或“ ”
” 。
。
(3)若30min时,保持 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各 ,则此时反应______移动
,则此时反应______移动 填“正向”“逆向”或“不”
填“正向”“逆向”或“不” 。
。
-
近年来,我国机动车保有量持续增长,汽车尾气排放已成为城市的主要污染源,汽车尾气催化净化成为及其重要的环保产业。回答下列问题:
(1)用活性炭还原法可以处理汽车尾气中氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 
| 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①第一次达平衡时,NO的转化率为_____________ ,T1℃时,该反应的平衡常数K=_______________。
②30min后只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________;
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=________。
④若升高温度为T2℃,该反应是平衡常数K减小,原因是_______________。
(2)在汽车排气管加装催化转换器,可有效降低污染物的浓度。已知,催化转换器的效率计算:
ηi=  ×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
| 温度/℃ | 流量/(m3·h-1) | CxHy/(106ppm) | CO/% | NOx/(106ppm) |
| 入口 | 100 | 0.2 | 139 | 2.66 | 21 |
| 出口 | 31 | 0 | 0 |
①在上述条件下,η(CO)、η(NOx)均达100%,η(CxHy)=_____________。
②两种不同的催化剂JFG和HPA-8在不同温度、流量下CxHy的去除率如图所示:
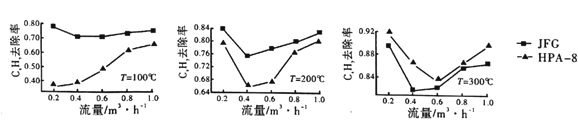
比较两种催化剂在不同温度下对CxHy的转化效率,由此可得出的结论是____________。
-
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = − 393.5kJ·mol−1
2C(s)+O2(g) == 2CO(g) △H2 = − 221.0 kJ·mol−1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L−1·s−1。
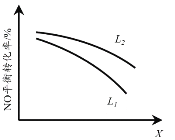
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。

① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
-
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g) = 2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(______)−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(______)−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L−1·s−1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
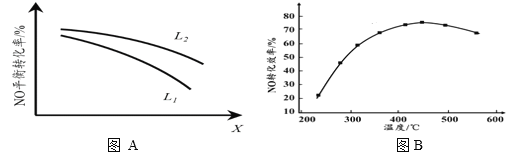
II. 有人利用反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
-
机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 =− 393.5kJ·mol−1
2C(s)+O2(g) = 2CO(g) △H2 =− 221.0 kJ·mol−1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol−1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(______)−4mol·L−1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(______)−3mol·L−1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L−1·s−1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或 “=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = −34.0 kJ·mol−1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
-
自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
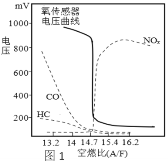
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。
(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g) 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+ O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g)  3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
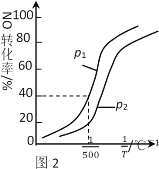
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4▪H2O⇌ +OH-,则
+OH-,则 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)⇌[Ag(NH3)2]+(aq),其平衡常数表达式为Kf = =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____mol•L-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc mol•L-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____mol•L-1(保留三位有效数字,提示: ≈3.16)。
≈3.16)。
-
汽车尾气污染是由汽车排放的废气造成的环境污染。主要污染物为一氧化碳、碳氢化合物、氮氧化合物等,对人类和动、植物危害甚大。解决汽车尾气问题的主要方法是研究高效催化剂促使尾气中的一氧化碳和氮氧化物反应,转化成无污染的氮气和二氧化碳。
回答下列问题:
(1)在Co+的催化作用下,CO(g)还原N2O(g)的反应历程和能量变化如图所示(逸出后物质认为状态下发生变化,在图中略去)。已知总反应的化学方程式为:CO(g)+N2O(g) CO2(g)+N2(g)。
CO2(g)+N2(g)。
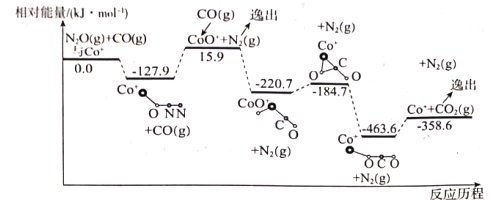
该反应分两步进行:
第一步:Co+(s)+N2O(g) CoO+(s)+N2(g) △H1=+15.9kJ•mol-1;
CoO+(s)+N2(g) △H1=+15.9kJ•mol-1;
笫二步:___;△H2=___;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为___。
(2)500℃条件下,在容积均为2L的三个密闭容器中,按不同方式投入反应物,发生上述反应,测得相关数据如下表:
| 容器 | 反应物投入的量 | 平衡时 n(N2/mol) | 达到平衡所需时间/min | 平衡时能量变化/kJ |
| 甲 | 1molCO和1molN2O | n1 | t1 | 放热Q1 |
| 乙 | 2molCO和2molN2O | n2 | t2 | 放热Q2 |
| 丙 | 2molCO2和2molN2 | n3 | t3 | 吸热Q3 |
①Q1+ ___358.6(填“>”“=”或“<”下同,t1___t2;
___358.6(填“>”“=”或“<”下同,t1___t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
| t/s | 0 | 20 | 40 | 60 | 80 | 120 |
| 乙 | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
| 丙 | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=___;该反应的平衡常数K数值为:___;(保留3位有效数字)
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置___。

(3)若将CO(g)还原N2O(g)的反应设计成如图的原电池装置,则该电池正极的电极反应式为___。
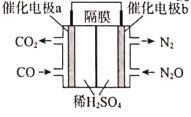
-
汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
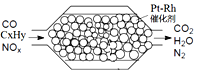
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
比值不变

2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
=___L/mol。
CH4(g)+2H2O(g) △H<0

的关系如图所示:















