-
H2S 为二元弱酸,20 ℃的 pKa1=6.89,pKa2=14.15(电离常数 K 的负对数-lg K=pK)。在20 ℃时,向 0.1 mol·L‑1 的 Na2S 溶液中缓慢通入 HCl(忽略溶液体积变化和 H2S 的挥发),在该过程中下列微粒物质的量浓度关系一定正确的是
A.溶液中 c(HS-)=c(S2-)时,c(S2-)+2c(H2S)<c(Cl-)
B.溶液呈中性时,c(HS- )+c(H2S)=c(Cl- )
C.溶液 pH=6.89 时,c(Cl- )>c(HS- )=c(H2S)>c(H+)>c(OH-)
D.溶液中 c(Cl-)=0.2 mol·L-1 时,c(OH-)+c(HS- )+c(S2-)=c(H+)
高三化学单选题中等难度题查看答案及解析
-
H2S为二元弱酸,20 ℃的pKa1=6.89,pKa2=14.15(电离常数K的负对数-lg K=pK)。在20 ℃时,向0.1 mol·L-1的Na2S溶液中缓慢通入HCl(忽略溶液体积变化和H2S的挥发),在该过程中下列微粒物质的量浓度关系一定正确的是( )
A.溶液中c(HS-)=c(S2-)时,c(S2-)+2c(H2S)<c(Cl-)
B.溶液呈中性时,c(HS-)+2c(H2S)=c(Cl-)
C.溶液pH=6.89时,c(Cl-)>c(HS-)=c(H2S)>c(H+)>c(OH-)
D.溶液中c(Cl-)=0.2 mol·L-1时,c(OH-)+c(HS-)+c(S2-)=c(H+)
高三化学多选题困难题查看答案及解析
-
已知电离常数的负对数pK=-lgK,25℃时,HX的pKa=4.76,H2Y的pKa1=1.22,pKa2=4.19,下列说法正确的是( )
A.浓度相等的NH4X和NH4HY溶液中c(NH4+):前者大于后者
B.NaX溶液中滴加KHY溶液至pH=4.76:c(K+)+c(Na+)>c(HY-)+2c(Y2-)+c(X-)
C.KHY溶液中滴加氨水至中性:c(NH4+)>c(Y2-)
D.K2Y溶液中滴加盐酸至pH=1.22:c(Cl-)-3c(HY-)=c(H+)-c(OH-)
高三化学单选题中等难度题查看答案及解析
-
已知:25℃时 H2C2O4 的 pKa1=1.22,pKa2=4.19,CH3COOH 的 pK a=4.76,K 代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为 0.1mol·L-1NH4HC2O4 和 CH3COONH4 溶液中:c(NH4+)前者小于后者
B. 将 0.1mol·L-1 的 K2C2O4 溶液从 25℃升温至 35℃,c(K+)/c (C2O42-) 减小
C. 0.1 mol·L-1K2C2O4 溶液滴加盐酸至 pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向 0.1 mol·L-1CH3COONa 溶液中滴加少量 0.1 mol·L-1H2C2O4 溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4
高三化学单选题困难题查看答案及解析
-
(2018·天津市十二重点中学毕业班联考)已知:25℃时H2C2O4的pKa1=1.22,pKa2=4.19,CH3COOH的pK a=4.76,K代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,
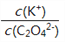 减小
减小C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向0.1 mol·L-1CH3COONa溶液中滴加少量0.1 mol·L-1H2C2O4溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4-
高三化学单选题中等难度题查看答案及解析
-
已知:25℃时H2C2O4 的pKa1=1.22,pK a2=4.19,CH3COOH 的pK a=4.76 (电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性: (NH4+)<c(C2O4 2-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22: C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa 溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c( HC2O4 -)>c(C2O42- )>c(CH3COO-)
高三化学多选题困难题查看答案及解析
-
已知:25℃时H2C2O4 的pKa1=1.22,pK a2=4.19,CH3COOH 的pK a=4.76 (电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性: (NH4+)<c(C2O4 2-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22: C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa 溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c( HC2O4 -)>c(C2O42- )>c(CH3COO-)
高三化学多选题困难题查看答案及解析
-
25℃时,二元酸H3PO3的pKa1、pKa2(pK=-lgK)依次为1.30、6.60,氨水的pKb为4.75。常温时,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1NH4H2PO3溶液中:c(H3PO3)>c(NH3·H2O)>c(H+)>c(OH-)
B.0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO3-)=c(HPO32-)
C.0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH4+)=c(H2PO3- )+c(HPO32-)
D.0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1
高三化学多选题困难题查看答案及解析
-
25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是
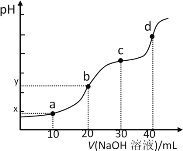
A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且
<1
高三化学单选题困难题查看答案及解析
-
25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21.下列有关说法错误的是
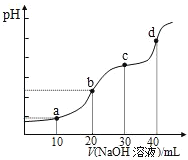
A.H2R + R2−⇌2HR−平衡常数K>105,反应趋于完全
B.常温下,Kh(HR-)的数量级为10-13
C.点b时,pH<7且 c(R2−)·c(H+)<c(H2R)·c(OH−)
D.点c时,溶液中2c(OH−)-2c(H+)=3c(H2R)+ c(HR−)-c(R2−)
高三化学单选题中等难度题查看答案及解析