-
B、C、N、Mg、Al、Si均是重要短周期元素,其化合物在工业中有重要用途。请回答下列问题:
(1)硼氢化合物B2H6的结构如图所示,则B原子的杂化方式为___。2个硼原子与4个氢原子形成普通的σ键。这四个σ键在同一平面上,另外两个氢原子和这两个硼原子形成了两个垂直于该平面的“氢桥键”,该“氢桥键”为___中心___(原子)电子键(填阿拉伯数字)。
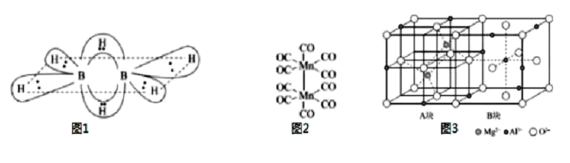
(2)CF4和PF3的沸点比较CF4___PF3(选填“>”或“<”)。PCl5中P原子采用sp3d杂化,形成三角双锥结构,而N原子只能形成NCl3,不能形成NCl5的原因是___。
(3)基态Mn原子核外特征电子排布式为___;已知CO的结构为C O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。
(4)环状基型硅酸盐中硅氧四面体共角氧相连,并封闭成环,分单层环与双层环两大类,双层三环Si6O15,双层四环Si8O20、双层六环Si12O30、双层n环Si2nOm,当n=10时,m=___。
(5)尖晶石的结构如图3所示,请写出尖晶石的化学式___;A块、B块均为边长为apm的立方体,设阿伏伽德罗常数的值为NA,最近两个Al3+之间的距离为___pm,尖晶石的密度为___g/cm3(列出计算式)。
-
铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
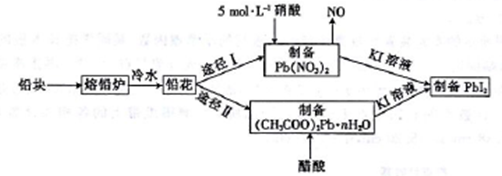
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
⑶写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
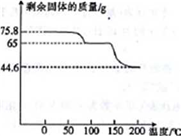
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
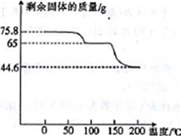
①(CH3COO)2Pb • nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。
-
铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
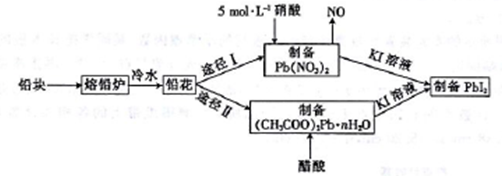
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
⑶写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb • nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。
-
铅及并化合物在工业生产中具有非常广泛的用途,根据以下流程回答相关问题。
(1)铅是碳的同族元素,且比碳多4个电子层,则铅位于元素周期表第___周期__族。
(2)反位条件的控制在工业生产中有着极其重要的作用。把铅块制成铅花的目的是_______。途径I中不用14 mol·L-1的浓硝酸制备硝酸铅的原因是______________________。
⑶写出(CH3COO)2Pb溶液[(CH3COO)2Pb 为弱电解质]与KI溶液反应的离子方程式:_________。
(4)取75.8 g (CH3COO)2Pb • nH2O样品在N2气氛中加热,测得剩余固体质量随温度的变化如图所示(样品在75℃时已完全失去结晶水)。
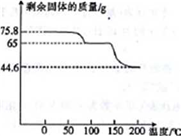
①(CH3COO)2Pb • nH2O中n=______。
②150~200℃间分解产物为PbO和一种有机物M,M能与水反应生成乙酸,则该温度区间内分解反应的化学方程式为________________________________。
(5)T℃时,取一定量的PbI2固体,用蒸馏水配制成饱和溶液。准确移取25.00mL PbI2饱和溶液,分次加入阳离子交换树脂RH(发生反应:2RH+Pb2+==R2Pb+2H+)中,用250 mL洁净的锥形瓶接受流出液,用蒸馏水淋洗树脂至流出液呈中性。将洗涤液一并盛放到锥形瓶中,加入酚酞,用0.0025 mol·L-1的NaOH溶液滴定,重复上述操作2次,当达到滴定终点时,平均消耗氢氧化钠溶液20.00 mL。则T℃时PbI2的Ksp=_______________________。
-
硼(B)及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B元素的化合价为___。
 工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为___。NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为___。
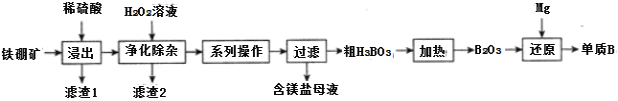
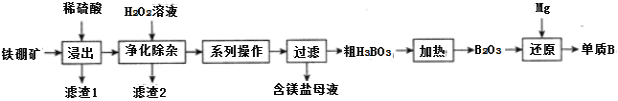
(2)工业上以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的PH | 2.7 | 3.1 |
| 沉淀完全的PH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为___。
“浸出”时,将铁硼矿石粉碎的目的为___。
 滤渣1的主要成分为___。
滤渣1的主要成分为___。
 “净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
“净化除杂”时需先加H2O2溶液,其目的为___,然后再调节溶液的pH≈5.0的目的是___。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.025g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-)至终点,消耗18.00mLNa2S2O3溶液。盛装Na2S2O3溶液应用___(填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为___。
-
已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_______________________。
(2)砷与氢元素可形成化合物砷化氢,该化合物的空间构型为_____________,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式________。
(4)已知由元素砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中砷原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式____________;
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定铝原子在三维空间中堆积方式________________(已知NA=6.02×1023,1pm=10-10cm,4053=6.64×107);晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______pm.(只列出计算式即可)
-
硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等
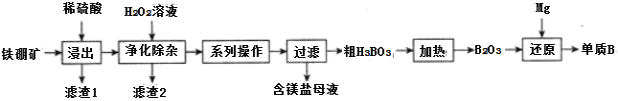
等 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:
已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的pH | 2.7 | 3.1 |
| 沉淀完全的pH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
 滤渣1的主要成分为______。
滤渣1的主要成分为______。
 “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______ 填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
-
硼及其化合物在化学工业中有诸多用途。请回答下列问题:
(1)硼氢化钠NaBH4是硼的重要化合物。
①NaBH4中B元素的化合价为______。
 工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
工业上可利用硼酸甲酯B(OCH3)3与氢化钠NaH反应制备NaBH4,反应的另一种产物为甲醇钠(CH3ONa),该反应的化学方程式为______。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为______。
(2)工业上以铁硼矿 主要成分为Mg2B2O5·H2O和Fe3O4,还有少量
主要成分为Mg2B2O5·H2O和Fe3O4,还有少量 、FeO、CaO、
、FeO、CaO、 和
和 等
等 为原料制备单质B的工艺流程如图所示:
为原料制备单质B的工艺流程如图所示:
已知:
| 金属离子 | Fe3+ | Al3+ |
| 开始沉淀的pH | 2.7 | 3.1 |
| 沉淀完全的pH | 3.7 | 4.9 |
 “浸出”时,将铁硼矿石粉碎的目的为______。
“浸出”时,将铁硼矿石粉碎的目的为______。
 滤渣1的主要成分为______。
滤渣1的主要成分为______。
 “净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
“净化除杂”时需先加H2O2溶液,其目的为______,然后再调节溶液的pH≈5.0的目的是______。
 制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将
制得的粗硼在一定条件下能生成BI3,BI3加热分解可以得到纯净的单质硼。现将 粗硼制成的BI3完全分解,生成的
粗硼制成的BI3完全分解,生成的 用0.30mol·L-1Na2S2O3溶液滴定
用0.30mol·L-1Na2S2O3溶液滴定 至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______
至终点,消耗18.00mL Na2S2O3溶液。盛装Na2S2O3溶液应用______ 填“酸式”或“碱式”
填“酸式”或“碱式” 滴定管,该粗硼样品的纯度为______。
滴定管,该粗硼样品的纯度为______。
-
砷 是第四周期
是第四周期 族元素,可以形成
族元素,可以形成 、
、 、
、 、
、 等化合物,有着广泛的用途.回答下列问题:
等化合物,有着广泛的用途.回答下列问题:
(1)画出砷的原子结构示意图________.
(2)工业上常将含砷废渣(主要成分为 )制成浆状,通入
)制成浆状,通入 氧化,生成
氧化,生成 和单质硫.写出发生反应的化学方程式___________________.该反应需要在加压下进行,原因是_____________.
和单质硫.写出发生反应的化学方程式___________________.该反应需要在加压下进行,原因是_____________.
(3)已知: 


则反应 的
的 ________.
________.
(4) 时,将
时,将 、
、 和
和 溶液混合,发生反应:
溶液混合,发生反应: 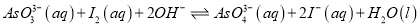 .溶液中
.溶液中 与反应时间
与反应时间 的关系如图所示.①下列可判断反应达到平衡的是________(填标号).
的关系如图所示.①下列可判断反应达到平衡的是________(填标号).
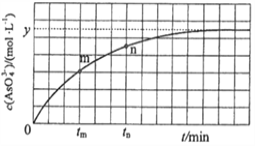
a. 溶液的 不再变化
不再变化
b. 
c.  不再变化
不再变化
d. 
② 时,
时,  ________
________  (填“大于”“小于”或“等于”).
(填“大于”“小于”或“等于”).
③ 时
时 ________
________  时
时 (填“大于”“小于”或“等于”),理由是________.
(填“大于”“小于”或“等于”),理由是________.
④若平衡时溶液的 ,则该反应的平衡常数
,则该反应的平衡常数 为________.
为________.
-
硼族元素是元素周期表中第ⅢA族元素,包括硼、铝、稼、铟、铊五种元素,它们的单质及化合物都有重要用途。请回答下列问题:
(1)硼、铝、稼三种元素第一电离能由大到小的顺序为___________;
(2)基态镓原子的价层电子轨道示意图为__________;
(3)AlC13是有机合成和石油化工的催化剂,常温下,纯AlC13为无色晶体,加热到180℃时升华,则固体氯化铝的晶体类型是_________;
(4)己知AlC13可以通过配位键形成具有桥式结构的双聚分子A12C16,A12C16分子的结构式为_________,双聚分子A12C16中Al原子的轨道杂化类型是________;
(5)氮化硼(BN)和磷化硼(BP)都是受到高度关注的耐磨涂料,它们的结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是_________________;
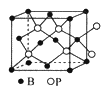
(6)磷化硼晶体的晶胞如图所示,在BP晶胞中B的堆积方式为_______,若图中立方体的边长为apm,则磷化硼中硼原子和磷原子之间的最近距离为___________。

O,Mn2(CO)10(结构如图2)中π键与配位键的个数比为___。









 .溶液中
.溶液中
