-
热化学和各类平衡等都是化学研究的对象
(1)已知:①2O2(g)+N2(g)=N2O4(l) ΔH1;
②N2(g)+2H2(g)=N2H4(g) ΔH2;
③O2(g)+2H2(g)=2H2O(g) ΔH3;
④2N2H4(g)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4 =___________(用含ΔH1、ΔH2、ΔH3的代数式表示)
(2)将不同量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)⇌H2(g)+CO2(g),得到如下表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| H2O | CO | H2 | CO |
| 1 | 800 | 2 | 4 | 4/3 | 8/3 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 0.6 | 3 |
| 3 | 900 | a | b | c | d | t |
① 该反应为________(填“吸热”或“放热”)反应;实验2的平衡常数K= _________。
② 若实验3达到平衡时与实验2达到平衡状态时各物质的体积分数分别相等,且t<3,则a、b应满足的关系是_______(用含a、b的代数式表示)。
③若保持温度和容积不变,向实验1再增加4mol H2O(g),使反应达到新平衡,下列说法不正确的是_______。
A.新旧平衡时容器气体压强之比为5:3
B.新平衡时H2O的转化率增大
C.新平衡时CO的浓度是0.8 mol·L-1
D.新旧平衡时容器气体密度之比为5:3
(3)室温下,用0.1 mol·L-1的KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
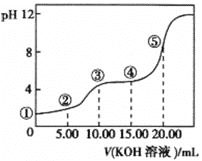
①点②所示的溶液中的电荷守恒式为_____________。
②点③所示溶液中各离子浓度由大到小的顺序为___________。
③点④所示溶液中c(K+) + c(H2C2O4 ) + c( ) + c(
) + c( ) =_______ mol·L-1。
) =_______ mol·L-1。
-
肼(N2H4)主要用作火箭和喷气发动机燃料。
(1) 已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态N2O4作推进剂,燃烧生成两种无污染的气体。写出反应的热化学方程式____。偏二甲肼(1,1-二甲基肼)也是一种高能燃料,写出其结构简式______。
(2)肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的化学方程式________,理论上,每消耗64 g肼可除去标准状况下O2________L
(3)科学家用肼作为燃料电池的燃料,电池结构如图1所示,
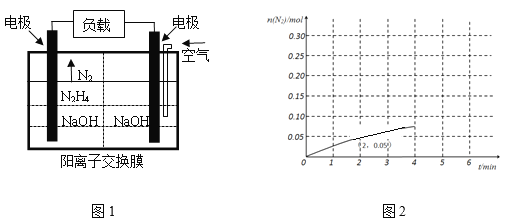
写出电池负极的电极反应式:________。
(4)N2H4在特定条件下(303K,Pt,Ni作催化剂)可以发生部分分【解析】
N2H4(g)  2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________。
-
(8分)某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。
已知:2NO2(g) N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为__________________。
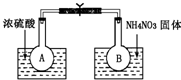
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如右图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。

请回答:
①A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向_____________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将_____________(选填“增大”“减小”或“不变”)。
-
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。

已知:2NO2(g) N2O4(g) ΔH=-52.7 kJ·mol-1
N2O4(g) ΔH=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为_______________。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答:
①加入浓硫酸的烧杯中溶液温度________,A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向________(选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将________(选填“增大”“减小”或“不变”)。
-
已知:N2O4(g) 2NO2(g) ,将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g) ,将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
-
已知:N2O4(g) 2NO2(g) ,将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g) ,将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
-
已知反应:2NO2(g)  N2O4(g)是放热反应,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol·L-1的HCl溶液和盛有500 mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。
N2O4(g)是放热反应,为了探究温度对化学平衡的影响,有人做了如下实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500 mL 6 mol·L-1的HCl溶液和盛有500 mL蒸馏水的烧杯中(两烧杯中溶液的温度相同)。

(1)该实验用两个经导管连通的烧瓶,其设计意图是__________。
(2)向烧杯甲的溶液中放入125g NaOH固体,同时向烧杯乙中放入125g硝酸铵晶体,搅拌使之溶解。甲烧瓶内气体的颜色将__________原因是__________乙烧瓶内气体的颜色将__________,原因是__________。
(3)该实验欲得出的结论是__________。
(4)某同学认为该实验的设计并不完全科学,他指出此时影响化学平衡的因素不止一个,你认为他所指的另一个因素是__________。
-
已知2NO2(g)⇌N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体.
请回答:
(1)A中的现象______,B中的现象______;
(2)由此可知,降低温度,该化学平衡向______(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为______,升高温度,该反应中NO2的转化率将______(填“增大”、“减小”或“不变”).
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭.
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深.
①推进针筒后颜色变深的原因是______;
②一段时间后气体颜色又变浅的原因是______;
③由此实验得出的结论是______.
(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是______;在此过程中,该反应的化学平衡常数将______ (填“增大”、“减小”或“不变”,下同),NO2的转化率将______.
-
(11分)已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。

请回答:
(1)A中的现象________,B中的现象 ________ ;
(2)由此可知,降低温度,该化学平衡向________(填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为________,升高温度,该反应中NO2的转化率将 ________(填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是________;
②一段时间后气体颜色又变浅的原因是________;
③由此实验得出的结论是 ________。
(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是 ________;
在此过程中,该反应的化学平衡常数将________ (填“增大”、“减小”或“不变”,下同),NO2的转化率将________。
-
(14分)已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。

请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是 ;
③由此实验得出的结论是 。
(2)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是 ;在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同),NO2的转化率将 。

) + c(
) =_______ mol·L-1。






