-
已知A、B、C、D、E、F、G都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族,G的最外层只有1个电子。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出E的电子排布式____________,E位于周期表____区。
(2)B、C、D的第一电离能由小到大的顺序为___________。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_________(填结构简式)
(4) 的空间构型为___________,键角为_______。
的空间构型为___________,键角为_______。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则第二种配合物的化学式为_______
(6)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞中平均含有___个B原子。若晶胞的棱长为acm,则它的密度为____g/cm3(NA表示阿伏加德罗常数)
(7)G的一种氧化物M的晶胞结构如图所示(小圆圈代表氧原子),则M的化学式为________,该晶体中氧原子的配位数为_______。
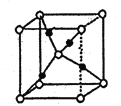
-
前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为_____, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为______;C、D和E的第一电离能由大到小的顺序是______;C和D最高价含氧酸的酸性由弱到强的顺序为_________。CO 中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为____________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为____________pm。
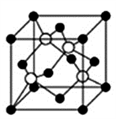
-
前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
-
A、B、C、D、E、F是原子序数依次增大的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层电子均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为____________________________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为____________________。
(3)C、D、E元素的第一电离能由大到小排序_________________。(用元素符号表示)
(4)A和D形成的18电子化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为___________________________。
(5)F与C形成化合物的晶胞如图所示,该化合物的化学式为__________,C离子的配位数是_________。此立方晶体的边长为a cm,则该晶体密度为__________g/cm3。

-
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
| A | 宇宙中含量最丰富的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D | 原子核外电子有8种不同的运动状态 |
| E | 基态原子核外有六个未成对电子 |
| F | 原子最外层只有一个电子 |
回答下列问题:
(1)基态E原子的核外M层电子云有 种不同的伸展方向,基态E原子核外价电子排布式为 ,元素F属于 区。
(2)A与C形成的最简单分子的空间构型为 ,中心原子的杂化方式为 。
(3)B,C,D的第一电离能由大到小的顺序是 (用元素符号表示);由B,C,D中的两种元素组成的常见分子互为等电子体的是 和
(4)E元素可以形成配位数为6的两种配合物,它们的化学式都是ECl3﹒6H2O,其 中一种呈亮棕色,与硝酸银溶液反应时,能沉淀出1/3的氯元素,该配合物可表示为 。
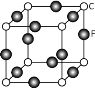
(5)元素F的一种氯化物的晶胞结构如图所示(黑球表示F原子,白球表示氯原子),每个氯原子周围与之距离最近的氯原子个数为 ;若晶胞的密度为4.14g﹒cm-3,该晶胞的边长为 cm(只要求列算式,不必计算出数值,阿附加德罗常数的数值为NA)
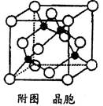
-
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是________个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如图)。
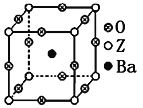
①制备A的化学方程式是_________________________________________;
②在A晶体中,Z的配位数为_______________;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的______________。
(4)R2+离子的外围电子层电子排布式为______________。R2O的熔点比R2S的________(填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如图),若晶胞棱长为540.0 pm,则晶胞密度为___________________________g·cm−3(列式并计算)。
 。
。
-
已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D元素简单离子半径是该周期中最小的 |
| E元素是该周期电负性最大的元素 |
| F所在族的元素种类是周期表中最多的 |
| G在周期表的第十一列 |
(1)已知BA5为离子化合物,写出其电子式__。
(2)B基态原子中能量最高的电子,其电子云在空间有__个方向,原子轨道呈__形。
(3)实验室制备E的单质的离子反应方程式为__。
(4)BE3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式__;该反应说明其中B和E中非金属性较强的是__填元素的符号。
(5)C与D的第一电离能大小为__。D与E的最高价氧化物对应水化物相互反应的离子方程式为__。
(6)G价电子排布图为__,位于__纵行。F元素的电子排布式为__,前四周期中未成对电子数最多的元素在周期表中位置为__(填周期和族)。
-
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A是宇宙中最丰富的元素, B原子的价电子排布为nsnnpn,D的最外层电子数是内层电子的3倍。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态F原子的价电子排布式__。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)__。
(3)BD32-中心原子杂化轨道的类型为__杂化;CA4+的空间构型为__(用文字描述)。
(4)1molBC-中含有π键的数目为__NA。
(5)D、E元素与A形成最简单氢化物的沸点较高的是_(填化学式),理由是__。
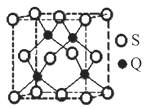
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是__,C原子的配位数是__。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为__g/cm3(用含a、NA的符号表示)。
-
(10分)X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
-
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的第一电离能由大到小的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3) X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
的空间构型为___________,键角为_______。




 。
。