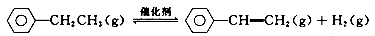-
苯乙烯是重要的化工原料。以乙苯(C6H5—CH2CH3) 为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应方程式为:C6H5—CH2CH3(g) C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mo1-1
C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mo1-1
回答下列问题:
(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mo1-1
C6H5—CH2CH3(g)+21/2O2(g)=8CO2(g)+5H2O(l) ΔH=-4607.1 kJ·mo1-1
则C6H5—CH=CH2(g)+10O2(g)= 8CO2(g)+4H2O(l) ΔH=_____________。
(2)工业上,在恒压设备中进行上述反应制取苯乙烯,常在乙苯蒸气中通入大量水蒸气。请用化学平衡理论解释通入大量水蒸气的原因_________________________________________。
(3)已知T℃下,将amol乙苯蒸气通入到体积为VL的密闭容器中进行上述反应,反应时间与容器内的总压强数据如下表:
| 时间t/min | 0 | 10 | 20 | 30 | 40 |
| 总压强p/1000kPa | 1.0 | 1.3 | 1.45 | 1.5 | 1.5 |
①由表中数据计算0~10 min内v(C6H5—CH2CH3)=________________。(用含a、V 的式子表示)
②该反应平衡时乙苯的转化率为_________________________。
(4)苯乙烯与溴化氢发生的加成反应产物有两种,其反应方程式如下:
i.C6H5—CH=CH2(g)+HBr(g) C6H5—CH2CH2Br (g)
C6H5—CH2CH2Br (g)
ii.C6H5—CH=CH2(g)+HBr(g) C6H5—CHBrCH3(g)
C6H5—CHBrCH3(g)
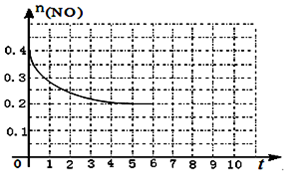
600℃时,向3L 恒容密闭容器中充入1.2 mol C6H5—CH=CH2(g)和1.2 mol HBr(g)发生反应,达到平衡时C6H5—CH2CH2Br (g)和C6H5—CHBrCH3(g)的物质的量(n)随时间(t)变化的曲线如图所示。
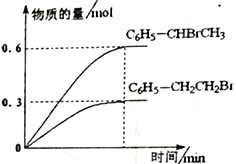
①600℃时,反应ii 的化学平衡常数K ii=__________________。
②反应平衡后,若保持其它条件不变,向该容器中再充入1mol C6H5—CH2CH2Br (g),则反应ii 将_________(“正向”、“逆向”或“不”)移动。
③在恒温恒容的密闭容器中,苯乙烯与溴化氢发生i、ii两个加成反应,判断反应已达到平衡状态的是______。
A.容器内的密度不再改变
B.C6H5—CH2CH2Br (g)的生成速率与C6H5—CHBrCH3 (g)分解速率相等
C.反应器中压强不再随时间变化而变化
D.混合气体的平均相对分子质量保持不变
-
苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
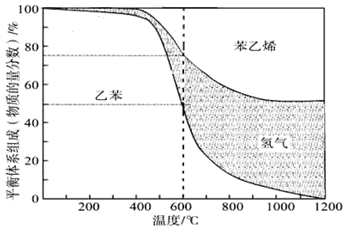
600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g) C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。

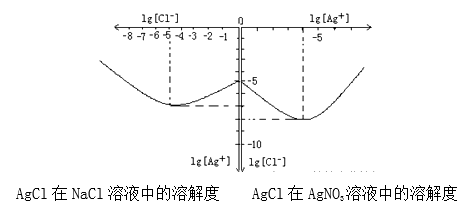
(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。

-
苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
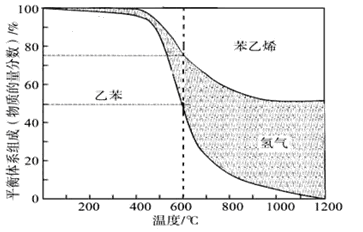
600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g) C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。
-
苯乙烯是重要的基础有机化工原料.工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3 (g) C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
C6H5-CH=CH2 (g) +H2(g) ΔH=a kJ•mol﹣1
(1)向体积为VL的密闭容器中充入n mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
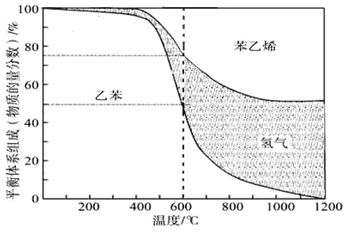
600℃时,该反应的平衡常数_____________。
(2)乙苯在特定催化剂下发生氧化脱氢:
C6H5-CH2CH3(g)+1/2O2(g) C6H5-CH=CH2(g)+H2O(g) ΔH1
C6H5-CH=CH2(g)+H2O(g) ΔH1
已知 H2的燃烧热ΔH= b kJ/mol,水的汽化热为c J/g,则 ΔH1=____________。
(3)在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。
N2(g)+2CO2(g) △H<0。则该反应在_________ (填“高温”、“低温”或“任何温度”)下能自发进行。在某温度下,2L 密闭容器中充入NO、CO各0.4mol进行反应,测得NO物质的量变化如图所示,5分钟末反应达到平衡。第6分钟继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线_________。

(4)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
①由图知该温度下AgCl的溶度积常数为_________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:_______________。
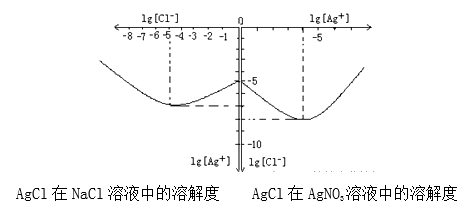
-
苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式:
 △H(1)已知:
△H(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
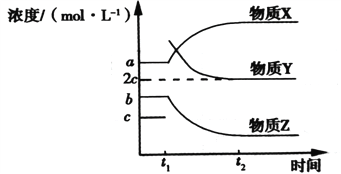
(2)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。物质X为__________,判断理由是_______________________。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]
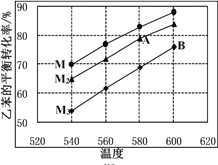
① 比较图中A、B两点对应的平衡常数大小:KA________KB
② 图中投料比(M1、M2、M3)的大小顺序为________。
-
(14分)苯乙烯(C6H5CH=CH2)是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等。工业上以乙苯(C6H5CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:
C6H5CH2CH3(g)  C6H5CH=CH2(g)+H2(g)
C6H5CH=CH2(g)+H2(g)  H
H
(1)已知:H2和CO的燃烧热( H)分别为-285.8 kJ.mol
H)分别为-285.8 kJ.mol 和-283.0 kJ.mol
和-283.0 kJ.mol ;
;
C6H5CH2CH3(g)+CO2 (g) C6H5CH=CH2(g)+CO(g)+H2O(l)
C6H5CH=CH2(g)+CO(g)+H2O(l)  H=+114.8 kJ·mol-1
H=+114.8 kJ·mol-1
则制取苯乙烯反应的 H为_________
H为_________
(2)向密闭容器中加入1 mol乙苯,在恒温恒容条件下合成苯乙烯,达平衡时,反应的能量变化为QkJ。下列说法正确的是 _________。
A.升高温度,正反应速率减小,逆反应速率增大
B.若继续加入1 mol乙苯,苯乙烯转化率增大
C.压缩体积,平衡逆向移动,反应物浓度增大,生成物浓度减小
D.相同条件下若起始加入1 mol苯乙烯和1 mol氢气,
达平衡时反应能量变化为( H-Q)kJ
H-Q)kJ
(3)向2 L密闭容器中加入1 mol乙苯发生反应,达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示。700 时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970
时,乙苯的平衡转化率为_______,此温度下该反应的平衡常数为 ______;温度高于970 时,苯乙烯的产率不再增加,其原因可能是_________。
时,苯乙烯的产率不再增加,其原因可能是_________。
(4)含苯乙烯的废水排放会对环境造成严重污染,可采用电解法去除废水中的苯乙烯,基本原理是在阳极材料MOx上生成自由基MOx(OH),其进一步氧化有机物生成CO2 ,该阳极的电极反应式为_________,若去除0.5 mol苯乙烯,两极共收集气体_________mol。
-
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
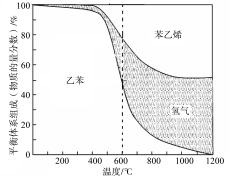
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g) + C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
-
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
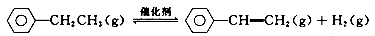
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
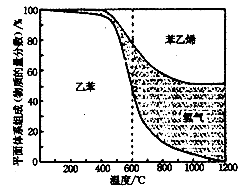
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知:
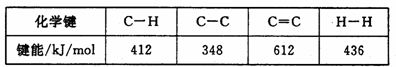
计算上述反应的ΔH= kJ/mol。
-
1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g) CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJ•mo1-1。
| 化学键 | C-C | C=C | C-H | H-H |
| 键能/kJ•mol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
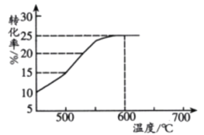
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPa•h-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
-
苯乙烯是重要的基础有机化工原料。工业中以乙苯催化脱氢来制取苯乙烯:
 (g)⇌
(g)⇌ (g)+H2(g) ∆H=117.6kJ/mol
(g)+H2(g) ∆H=117.6kJ/mol
已知:上述反应的速率方程为v正=k正P乙苯,v逆=k逆P苯乙烯P氢气,其中k正、k逆分别为正、逆反应速率常数,P为各组分分压。
(1)同时增大乙苯的反应速率和平衡转化率所采取的措施是_______________。
(2)在CO2气氛下,乙苯可催化脱氢制苯乙烯,其过程同时存在如图两种途径:
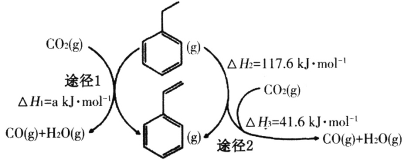
a=______;与掺水蒸汽工艺相比,该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有__________(填序号)。
a.CO2与H2反应,使乙苯脱氢反应的化学平衡右移
b.不用高温水蒸气,可降低能量消耗
c.有利于减少生产过程中可能产生的积炭
d.CO2在反应体系中作催化剂
(3)在实际生产中,往反应釜中同时通入乙苯和水蒸气,加入水蒸气稀释剂能提高乙苯转化率的原因是_______________。测得容器总压(P总)和乙苯转化率α随时间变化结果如图所示。平衡时,P(H2O)=_______kPa,平衡常数Kp=____kPa(用平衡分压代替平衡浓度计算);a处的 =_________。
=_________。

C6H5—CH=CH2(g)+H2(g) ΔH=+117.6 kJ·mo1-1
C6H5—CH2CH2Br (g)
C6H5—CHBrCH3(g)










 △H(1)已知:
△H(1)已知: