-
现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
-
现有下列反应:
①、2H2O+Cl2+SO2=H2SO4+2HCl
②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O
针对上述两个反应回答:
(1)配平②的化学方程式________;
(2)用单线桥标出①中电子转移的方向和数目________;
(3)Cl2、SO2和KMnO4的氧化性强弱顺序为____;
(4)反应①中氧化产物和还原产物的物质的量之比为___;
(5)反应②中氯化氢表现出的性质是___。
A.还原性 B.酸性 C.氧化性
【答案】 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 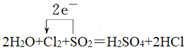 KMnO4 >Cl2>SO2 1:2 ab
KMnO4 >Cl2>SO2 1:2 ab
【解析】(1)Mn元素化合价从+7价降低到+2价,得到5个电子。氯元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒和原子守恒可知反应②的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;(2)反应①中氯元素化合价从0价降低到-1价,S元素化合价从+4价升高到+6价,因此转移2个电子,则用单线桥表示①中电子转移的方向和数目为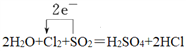 ;(3)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据反应的方程式可知Cl2、SO2和KMnO4的氧化性强弱顺序为KMnO4 >Cl2>SO2;(4)反应①中氧化产物和还原产物分别是硫酸和氯化氢,物质的量之比为1:2;(5)反应②中还有氯化锰生成,所以氯化氢表现出的性质除了还原性以外还有酸性,答案选ab。
;(3)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据反应的方程式可知Cl2、SO2和KMnO4的氧化性强弱顺序为KMnO4 >Cl2>SO2;(4)反应①中氧化产物和还原产物分别是硫酸和氯化氢,物质的量之比为1:2;(5)反应②中还有氯化锰生成,所以氯化氢表现出的性质除了还原性以外还有酸性,答案选ab。
【题型】填空题
【结束】
24
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
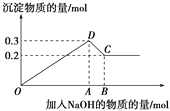
(1)写出代表各线段发生的反应的离子方程式:
OD段________________________________________________,
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。
(3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。
(4)图中线段OA∶AB=________。
-
已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
-
已知有下列反应:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
根据上述两个反应回答:
(1)Cl2、KMnO4、H2SO4三者氧化性强弱顺序为______________,Cl-、SO2、Mn2+三者还原性强弱顺序为___________。
(2)反应①中氧化产物和还原产物的质量之比为________。
(3)反应②中浓盐酸表现出的性质是________。
A.还原性 B.酸性 C.氧化性
(4)用双线桥法标出反应②电子转移的方向和数目_________________
-
有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O②2H2O+Cl2+SO2=H2SO4+2HCl
下列说法不正确的是( )
A.还原性SO2>HCl>MnCl2
B.氧化性KMnO4>MnO2>Cl2
C.反应①中HCl表现出酸性和氧化性
D.反应②中水既不是氧化剂也不是还原剂
-
已知下列几个反应的化学方程式:
①2KI+Cl2=2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+I2+2HCl;
④I2+SO2+2H2O=H2SO4+2HI。下列有关物质的氧化性的强弱排列顺序中正确的是
A.Cl2>Fe3+>I2>SO2 B.Cl2>I2>Fe3+>SO2
C.Cl2>Fe3+>SO2>I2 D.Fe3+>I2>Cl2>SO2
-
下列哪一个反应表示二氧化硫被还原 ( )
A. SO2+2H2O+Cl2===H2SO4+2HCl B. SO2+2H2S===2H2O+3S
C. SO2+2NaOH===Na2SO3+H2O D. SO2+Na2CO3===Na2SO3+CO2↑
-
下列哪一个反应表示二氧化硫被还原 ( )
A.SO2+2H2O+Cl2===H2SO4+2HCl B.SO2+2H2S===2H2O+3S
C.SO2+2NaOH===Na2SO3+H2O D.SO2+Na2CO3===Na2SO3+CO2↑
-
下列反应中,SO2表现氧化性的是( )
A.2SO2+O2 2SO3
2SO3
B.SO2+H2O═H2SO3
C.2H2S+SO2═3S↓+2H2O
D.SO2+2H2O+Cl2═H2SO4+2HCl
-
根据下列反应
①2H2S+SO2= 3S↓+2H2O ②2FeCl2+Cl2= 2FeCl3
③2FeCl3+2HI= 2FeCl2+2HCl+I2 ④I2+SO2+H2O= H2SO4+2HI
判断氧化性物质的氧化性由强到弱的顺序是
A. Cl2>I2>FeCl3>SO2>S B. Cl2>FeCl3>SO2>I2>S
C. Cl2>FeCl3>I2>SO2>S D. FeCl3>Cl2>I2>SO2>S
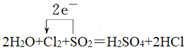 KMnO4 >Cl2>SO2 1:2 ab
KMnO4 >Cl2>SO2 1:2 ab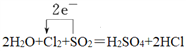 ;(3)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据反应的方程式可知Cl2、SO2和KMnO4的氧化性强弱顺序为KMnO4 >Cl2>SO2;(4)反应①中氧化产物和还原产物分别是硫酸和氯化氢,物质的量之比为1:2;(5)反应②中还有氯化锰生成,所以氯化氢表现出的性质除了还原性以外还有酸性,答案选ab。
;(3)氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,则根据反应的方程式可知Cl2、SO2和KMnO4的氧化性强弱顺序为KMnO4 >Cl2>SO2;(4)反应①中氧化产物和还原产物分别是硫酸和氯化氢,物质的量之比为1:2;(5)反应②中还有氯化锰生成,所以氯化氢表现出的性质除了还原性以外还有酸性,答案选ab。