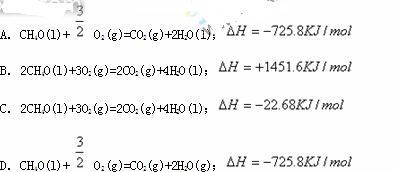-
煤转化为水煤气的主要化学反应为:C+H2O(g) CO+H2。C(s)、H2(g)和CO(g)完全燃烧的热化学方程式分别为:
CO+H2。C(s)、H2(g)和CO(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)===CO2(g) ΔH1=-393.5kJ·mol-1 ①
H2(g)+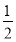 O2(g)===H2O(g) ΔH2=-242.0kJ·mol-1 ②
O2(g)===H2O(g) ΔH2=-242.0kJ·mol-1 ②
CO(g)+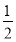 O2(g)===CO2(g) ΔH3=-283.0kJ·mol-1 ③
O2(g)===CO2(g) ΔH3=-283.0kJ·mol-1 ③
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:___________。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量(填“多”或“少”)________。
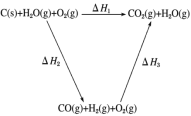
(3)甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律做出了下列循环图:
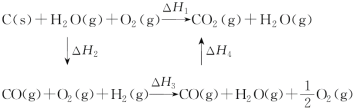
请你写出ΔH1、ΔH2、ΔH3、ΔH4之间存在的关系式:____________。
乙同学据此认为:“将煤转化为水煤气再燃烧,放出的热量最多与直接燃烧煤放出的热量相同。”请甲、乙两同学观点正确的是_________(填“甲”或“乙”)同学,
-
将煤转化为水煤气的主要化学反应为C(s)+H2O(g) CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ•mol-1
H2(g)+ O2(g)=H2O(g) ΔH=-242.0 kJ•mol-1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ•mol-1
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式: _______ 。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。请甲、乙两同学观点正确的是 _____(填“甲”或“乙”);判断的理由是________。
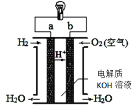
(3)CO、H2等可燃性气体可以设计成燃料电池,燃料电池是一种能量转化率较高的发电装置。如图是一种氢氧燃料电池示意图,则该电池a极的电极反应式为 ________ 。若将H2换成CH4,则该电池负极的电极反应式为 _______ 。
-
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O时,放出
445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是
A.1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O (l) ΔH =-445 kJ/mol
B.CH4+2O2=CO2+H2O ΔH=-890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2 H2O (l) ΔH =-890 kJ/mol
D.CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH = +890 kJ/mol
-
沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是
A.  CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l) ΔH =−445 kJ/mol
CO2(g)+H2O(l) ΔH =−445 kJ/mol
B. CH4+2O2=CO2+2H2O ΔH=−890 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2 H2O(g) ΔH =−890 kJ/mol
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH = −890 kJ/mol
-
沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O时,放出445KJ热量,则下列热化学方程式正确的是( )
A.2 CH4 (g)+4O2(g)=2CO2(g) +4H2O(l)△H=+890KJ/mol
B.CH4 +2 O2=CO2+2H2O△H=-890KJ/mol
C.CH4 (g)+2O2(g)=CO2(g) +2H2O(l)△H=-890KJ/mol
D.1/2 CH4 (g)+O2(g)= 1/2CO2(g) +H2O(l)△H=-890KJ/mol
-
沼气是一种新能源,它的主要成分是甲烷。0.5 molCH4完全燃烧生成CO2和H2O时,放出445 KJ热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)==2CO2(g)+4H2O(l) △H= + 890 KJ·mol-1
B.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= + 890 KJ·mol-1
C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= - 890 KJ·mol-1
D.1/2CH4(g)+O2(g)==1/2CO2(g)+H2O(l) △H= - 890 KJ·mol-1
-
沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,则下列热化学方程式正确的
A:2 CH4 (g)+4O2(g)=2CO2(g) +4H2O(l) △H=+890kJ/mol
B:CH4 +2O2=CO2+2H2O △H=-890kJ/mol
C:CH4 (g)+2O2(g)=CO2(g) +2H2O(l) △H=-890kJ/mol
D:1/2 CH4 (g)+O2(g)= 1/2CO2(g) +H2O(l) △H=-890kJ/mol
-
沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是
A. 2CH4(g)4O2(g)=2CO2(g)+4H2O(l)△H═+89 kJ/mol
B. CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═﹣890 kJ/mol
D.  CH4(g)+O2(g)=
CH4(g)+O2(g)= CO2(g)+H2O(l)△H═﹣890 kJ/mol
CO2(g)+H2O(l)△H═﹣890 kJ/mol
-
2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3放出的热量为99kJ。请回答下列问题:
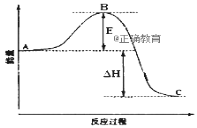
(1)图中△H=__________kJ•mol﹣1;
(2)E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_______。
(3)已知键能是指拆开1mol任何化学键时所放出的能量。根据下列数据回答问题:
| 化学键 | H—N | H—O | N≡N | O=O |
| 断键所需能/kJ/mol | 386 | 463 | 942 | 498 |
请写出NH3(g)完全燃烧生成N2和水蒸气的热化学反应方程式:_________。
(4)已知:H2O(l)=H2O(g) △H=+44.0 kJ/mol。液氢也是一种常用燃料,将煤与水蒸气在高温下反应是获取H2的重要方法。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
①C(s) + O2(g)=CO2(g) ∆H=–393.5 kJ/mol
②CO(g) + 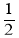 O2(g)=CO2(g) ∆H=–283.0 kJ/mol
O2(g)=CO2(g) ∆H=–283.0 kJ/mol
③H2(g) + 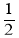 O2(g)=H2O(l) ∆H=–285.8 kJ/mol
O2(g)=H2O(l) ∆H=–285.8 kJ/mol
根据以上信息,则1mol C(s)与水蒸气反应生成H2和CO的热化学方程式为___。
-
 是,10KPa时,1g 甲醇完全燃烧,生成CO2和液态H2O,同时放出22.68KJ 热量,下列能表示该反应燃烧热的热化学方程式是 ( )
是,10KPa时,1g 甲醇完全燃烧,生成CO2和液态H2O,同时放出22.68KJ 热量,下列能表示该反应燃烧热的热化学方程式是 ( )
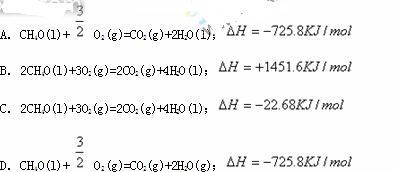
 CO+H2。C(s)、H2(g)和CO(g)完全燃烧的热化学方程式分别为:
CO+H2。C(s)、H2(g)和CO(g)完全燃烧的热化学方程式分别为: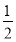 O2(g)===H2O(g) ΔH2=-242.0kJ·mol-1 ②
O2(g)===H2O(g) ΔH2=-242.0kJ·mol-1 ②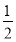 O2(g)===CO2(g) ΔH3=-283.0kJ·mol-1 ③
O2(g)===CO2(g) ΔH3=-283.0kJ·mol-1 ③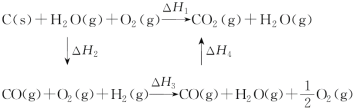
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为


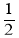 O2(g)=CO2(g) ∆H=–283.0 kJ/mol
O2(g)=CO2(g) ∆H=–283.0 kJ/mol