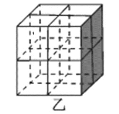
-
铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
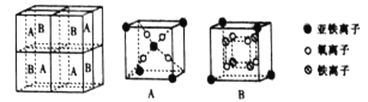
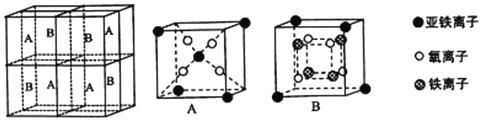
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
-
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(1)基态铁原子的价电子排布图为_______
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_____Fe3+(填“大于”或“小于”),原因是____。
(3)纳米氧化铁能催化火管推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),其中氮原子的杂化方式为______;与 ClO4-互为等电子体的分子或离子为_________(任写两种)。
(4)金属铁晶体原子采用体心立方堆积。则铁晶体的空间利用率为____ (用含π的式子表示)。
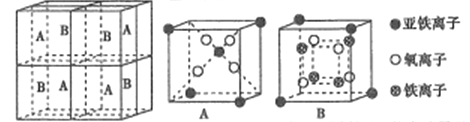
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。
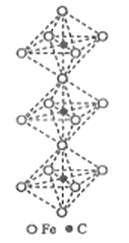
(6)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。
-
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
-
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
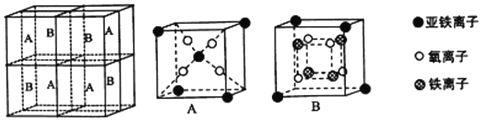
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
-
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。

-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
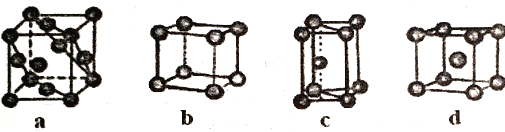
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
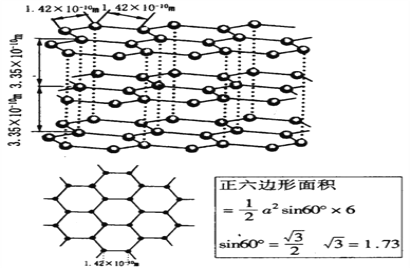
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
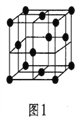
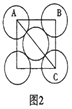
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。
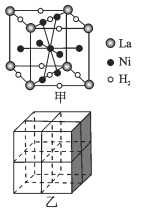
-
Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。
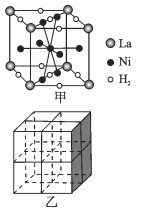
-
Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为_______。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行______。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是___,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为_____(填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)解释CO比N2的熔沸点高的原因___。
(6)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为___。
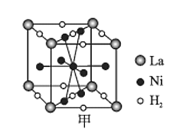
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___(填“八面体空隙”或“四面体空隙”)。若晶体的密度为d g/cm3,Mg2NiH4的摩尔质量为M g/mol,则Mg2+和Ni原子的最短距离为___nm(用含d、M、NA的代数式表示)。