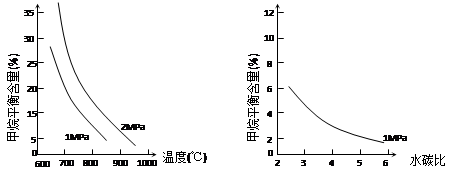-
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10mol CO 和20mol H2,
则在平衡状态B时容器的体积V(B)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
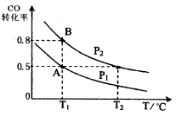
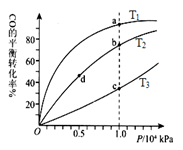
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
CH3OH(g),按照相同的物质的量 投料,测得CO在 不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由 CO2和H2制取甲醇的热化学方程式 。
-
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的 密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为________。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ________________ L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是________(填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是________(填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
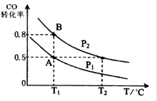
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是________。
CH3OH(g),按照相同的物质的量 投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是________。
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO2和H2制取甲醇的热化学方程式________。
-
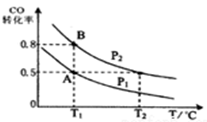
(12分)甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g )+2H2 ( g )  CH3OH ( g )
CH3OH ( g )  H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。
(1)该反应的化学平衡常数表达式为 。
(2)如反应开始时仍充入10 mol CO 和20 mol H2,则在平衡状态A时,容器的体积V(A)= L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)已知CO2(g)+H2(g) CO(g)+H2O(g) H=+41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式 。
CO(g)+H2O(g) H=+41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式 。
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用下图装置模拟上述过程:
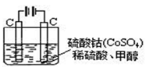
①写出阳极的电极反应式______________ _。
②写出除去甲醇的离子方程式_______________ ___。
-
甲醇可作为燃料电池的原料,以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJ•mol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJ•mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______。
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
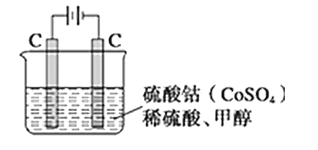
①完成除去甲醇的离子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:___。
-
(12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g )△H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H =—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为________。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如右图。
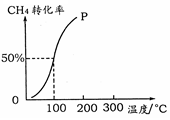
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100℃时反应I的平衡常数为________。
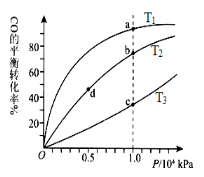
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是________ (填字母序号)。
A.c ( H2 )减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡c ( H2 )/ c (CH3OH )减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
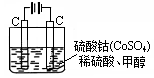
① 写出阳极电极反应式________。
② 写出除去甲醇的离子方程式________。
③若右图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:________,净化含1 mol甲醇的水燃料电池需消耗KOH
mol。
-
甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:
CO (g) + 2H2 (g) CH3OH (l) △H
CH3OH (l) △H
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H / kJ·mol-1 | -285.8 | -283.0 | -726.5 |
计算上述反应的△H= kJ·mol-1。
(2)在容积可变的密闭容器中充入1 mol CO ( g ) 和2 molH2 ( g )生成CH3OH( g ),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。

① 该反应的△S 0,图中的T1 T2(填“<”、“>”或“=”)。
② 当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。
③ 在该容器中,下列措施可增加甲醇产率的是 。
A.升高温度
B.从平衡体系中及时分离CH3OH
C.充入He
D.再充入0.5 mol CO和1 mol H2
(3)在容积固定为2 L的密闭容器中充入2 molCO( g )和6 molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如下图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图中画出15-25分钟c (CO)的变化曲线。
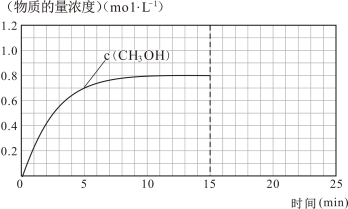
-
(12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g) + 2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。

①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
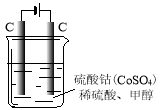
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
-
(12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I: CH4(g)+H2O(g)=CO(g) + 3H2(g) △H =+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。
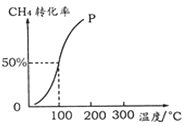
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c ( H2 )减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡c ( H2 )/ c (CH3OH )减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
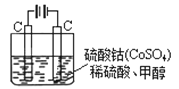
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
-
甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:CO(g)+2H2(g)===CH3OH(l) ΔH=?
(1)已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 453.0 kJ·mol-1
则制备甲醇反应的ΔH =____________ kJ·mol-1。
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
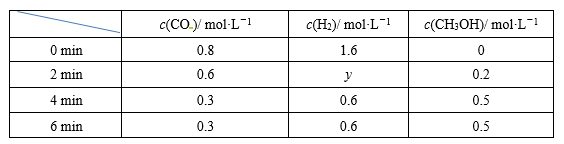
反应从2 min到4 min之间,H2的平均反应速率为__________mol·L-1·min-1。反应在第2 min时改变了反应条件,改变的条件可能是__________(填字母)。
A.使用催化剂 B.降低温度
C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 mol H2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(p)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为________,若达到平衡状态B 时,则容器的体积V(B)= ______ L。
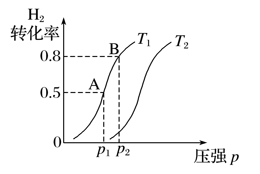
(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在下图中补画出从t2到t4正反应速率随时间的变化曲线。____________
-
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=_______________(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图:
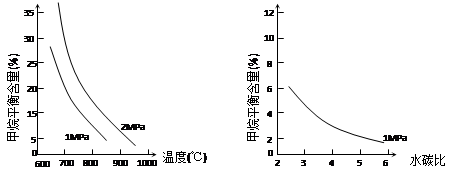
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是________。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
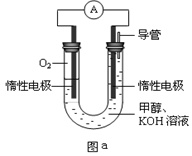
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为________________。
CH3OH ( g )
H=-90.8 kJ·mol-1,在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的 平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态B 时,容器的体积为4 L。

CH3OH(g)建立化学平衡状态时的标志是 (填字母)。
CO(g)+H2O(g) H=+41.3 kJ·mol-1 ,试写出由CO2和H2制取甲醇的热化学方程式 。