-
氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 。
(2)联氨在一定条件下可按下式分【解析】
3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN—H、N—N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ。若生成1molN2,则反应 (填“放出”或“吸收”) kJ的能量。
(3)NH3—O2燃料电池的结构如图所示。
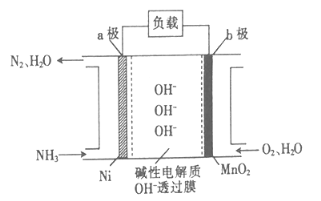
①a极为电池的 (填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为 。
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,该反应中氧化产物与还原产物的物质的量之比为 。
-
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件) 。
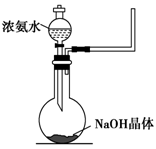
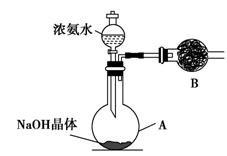
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
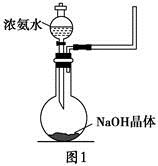
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是 (填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O 
 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气 个烧瓶。
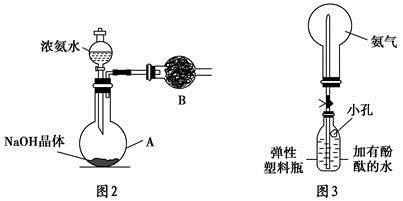
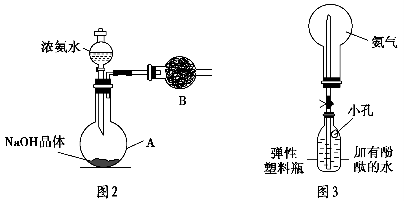
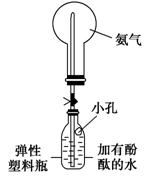
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是 。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法: 。
-
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。
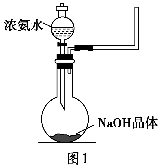
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________
-
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)__________________________________________________。
(2)实验室中还可以采用如图装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O  NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图,装置B中盛装的干燥剂是________。
②该同学利用图装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:____________________________________________________。
-
氨和肼(N2H4)既是一种工业原料,又是一种重要的化工产品。
(1)等物质的量的氨和肼分别与足量的二氧化氮反应,产物为氮气和水。则转移电子数目之比为_______。
(2)肼在一定条件下可发生分解反应:3N2H4(g)  N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
(3)氨的催化氧化过程主要有以下两个反应:
(i)4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H=-905.5kJ/mol
4NO(g)+6H2O(g) △H=-905.5kJ/mol
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1267 kJ/mol
2N2(g)+6H2O(g) △H=-1267 kJ/mol
①一定温度下,在2L密闭容器中充入10/3mol NH3与3mol O2发生反应(ii),达到平衡后测得容器中NH3的物质的量为2mol;则反应(ii)的化学平衡常数K=_________;维持温度和体积不变,向反应(ii)中再充入10/3mol NH3与3mol O2,达平衡后,N2(g)的体积分数将__________(填变大、变小、不变)。
②测得温度对NO、N2产率的影响如下图所示。下列说法错误的是_________。
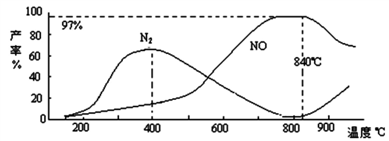
A.升高温度,反应(i)和(ii)的平衡常数均增大
B.840 ℃后升高温度,反应(i)的正反应速率减小,反应(ii)的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应(i)平衡逆向移动
D.800℃左右时,氨的催化氧化主要按照反应(i)进行
(4)N2H4-O2燃料电池是一种高效低污染的新型电池,其结构如图所示:
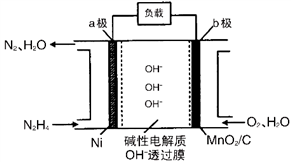
a极的电极反应方程式为______________; b极的电极反应为____________________。
-
(本题共12分)
氨气是重要的化工原料。
38.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱 b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气, 。
39.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为 ;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入 。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧
b.含碳物质燃烧
c.合成氨厂的副产品
40.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;②[Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因 。
41.某实验小组设计了下列装置进行氨的催化氧化实验。

(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为: 、 。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOH g。
-
氨气是重要的化工原料。
38.1.实验室可用浓氨水和_____(选填编号)来制取氨气。
a.烧碱 b.生石灰 c.氯化铵
检验氨气易溶于水的简单操作是:收集一试管氨气, 。
39.2.往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为 ;过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:再通入足量的NH3、冷却并加入 。
侯德榜制碱法(联合氨碱法)的CO2来自_____(选填编号)。
a.石灰石煅烧 b.含碳物质燃烧 c.合成氨厂的副产品
40.3.往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深(绛)蓝色,有[Cu(NH3)4]2+生成。往溶液中滴加稀硫酸,溶液变为淡蓝色。颜色变浅的主要原因可能是:
①溶液变稀;
② [Cu(NH3)4]2++4H+ Cu2+ + 4NH4+
Cu2+ + 4NH4+
请设计一个简单实验说明溶液变浅的主要原因 。
41.4.某实验小组设计了下列装置进行氨的催化氧化实验。

(1)实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因可用化学方程式表示为: 、 。
(2)实验前,烧杯中盛有200mL 1.000 mol/L NaOH溶液,实验后将烧杯中溶液蒸干,再将所得固体加热至恒重,得到固体10.9g,则该固体含NaOH g。
-
(1)氨气是重要的化工原料.实验室可用浓氨水和 来制取氨气.
a.烧碱 b.生石灰 c.氯化铵
(2)某实验小组设计了下列装置进行氨的催化氧化实验.
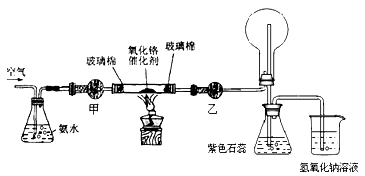
①盛放氨水的实验仪器的名称为 ;在加热条件下,硬质玻璃管中发生反应的化学方程式为 .
②实验时发现:如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中先产生白雾,随即产生白烟,其原因是 .
③烧杯中盛有NaOH溶液的作用是 .
-
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
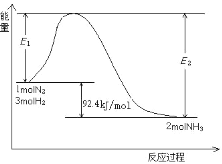
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
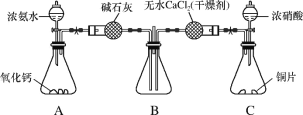
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
| 时间 | 1分钟 | 2分钟 | 3分钟 |
| 现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
-
氨气是一种重要的化工产品,工业上可以按照下图所示流程生产氨气:
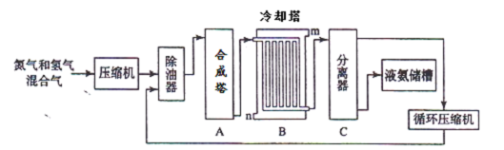
(1)原料气之一氮气的工业制取方法是 ,写出氨气的工业用途(任答一点) 。
(2)写出合成塔中发生的反应的化学反应方程式 。在冷却塔中对混合气体进行冷却,冷水的入口 (答m或n)。
(3)设备C的作用 。其分离器中的过程对整个工业合成氨的意义 (试结合平衡移动原理回答)。
(4)在原料气制备过程中混有 CO对催化剂有毒害作用,欲除去原料气中的 CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过80%,则起始物中c(H2O):c(CO)不低于 (精确到小数点后一位)。















