-
氨和肼(N2H4)既是一种工业原料,又是一种重要的化工产品。
(1)等物质的量的氨和肼分别与足量的二氧化氮反应,产物为氮气和水。则转移电子数目之比为_______。
(2)肼在一定条件下可发生分解反应:3N2H4(g)  N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
(3)氨的催化氧化过程主要有以下两个反应:
(i)4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H=-905.5kJ/mol
4NO(g)+6H2O(g) △H=-905.5kJ/mol
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1267 kJ/mol
2N2(g)+6H2O(g) △H=-1267 kJ/mol
①一定温度下,在2L密闭容器中充入10/3mol NH3与3mol O2发生反应(ii),达到平衡后测得容器中NH3的物质的量为2mol;则反应(ii)的化学平衡常数K=_________;维持温度和体积不变,向反应(ii)中再充入10/3mol NH3与3mol O2,达平衡后,N2(g)的体积分数将__________(填变大、变小、不变)。
②测得温度对NO、N2产率的影响如下图所示。下列说法错误的是_________。
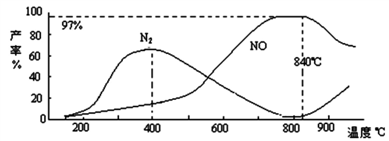
A.升高温度,反应(i)和(ii)的平衡常数均增大
B.840 ℃后升高温度,反应(i)的正反应速率减小,反应(ii)的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应(i)平衡逆向移动
D.800℃左右时,氨的催化氧化主要按照反应(i)进行
(4)N2H4-O2燃料电池是一种高效低污染的新型电池,其结构如图所示:
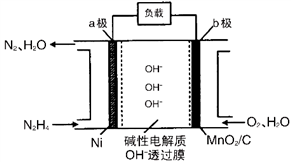
a极的电极反应方程式为______________; b极的电极反应为____________________。
-
NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法正确的是
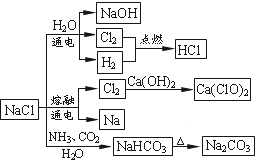
A.石灰乳与 的反应中,
的反应中, 既是氧化剂又是还原剂
既是氧化剂又是还原剂
B.电解饱和食盐水的阳极产物是H2
C.图示转化反应都是氧化还原反应
D. 与过量的铁反应生成
与过量的铁反应生成
-
NaCl是一种化工原料,可以制备一系列物质,如图所示。下列说法正确的是
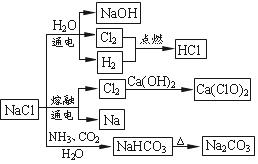
A.石灰乳与 的反应中,
的反应中, 既是氧化剂又是还原剂
既是氧化剂又是还原剂
B.电解饱和食盐水的阳极产物是H2
C.图示转化反应都是氧化还原反应
D. 与过量的铁反应生成
与过量的铁反应生成
-
实验室常利用以下反应制取少量氮气: =
= 关于该反应的下列说法不正确的是
关于该反应的下列说法不正确的是
A. 氮元素被还原
氮元素被还原
B.每生成 时,转移电子的物质的量为3mo1
时,转移电子的物质的量为3mo1
C.被氧化的氮原子与被还原的氮原子之比为1:1
D. 既是氧化产物,又是还原产物
既是氧化产物,又是还原产物
-
氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 。
(2)联氨在一定条件下可按下式分【解析】
3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN—H、N—N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ。若生成1molN2,则反应 (填“放出”或“吸收”) kJ的能量。
(3)NH3—O2燃料电池的结构如图所示。
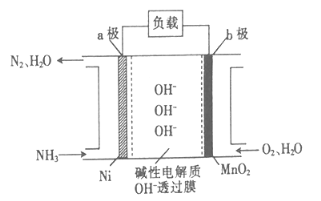
①a极为电池的 (填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为 。
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,该反应中氧化产物与还原产物的物质的量之比为 。
-
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O。关于该反应的下列说法正确的是
A.N2既是氧化产物又是还原产物
B.每生成1 mol N2转移电子的物质的量为6 mol
C.NH4Cl中的氮元素被还原
D.NaNO2是还原剂
-
CH4、CH3OH既是重要的化工原料,又是未来重要的能源物质。
(1)将1.0 mol CH4和2.0 mol H2O(g) 通入容积为2L的反应室,在一定条件下发生反应CH4(g)+H2O(g)  CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
CO(g)+3H2(g),测得在5 min时达到平衡,CH4的平衡转化率为40%。则0~5 min内,用H2O表示该反应的平均反应速率为_________。
(2)一定条件下,将1.0 mol CH4与2.0 mol H2O(g)充入密闭容器中发生反应CH4(g)+H2O(g)  CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
CH3OH(g)+H2(g),下列措施可以提高化学反应速率的是___________(填选项序号)。
a.恒容条件下充入He b.增大体积
c.升高温度 d.投入更多的H2O(g)
(3)在恒容条件下进行反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________ (填选项序号)。
CH3OH(g)+H2O(g),则下列实验事实可以作为判断该反应达到平衡状态标志的是___________ (填选项序号)。
a.消耗1 mol CO2同时生成1 mol CH3OH b.容器内压强保持不变
c.混合气体的密度保持不变 d.CH3OH(g)的浓度保持不变
(4)以KOH为电解质的甲醇-空气燃料电池是一种高效、轻污染的车载电池,其工作原理如图。 回答下列问题:
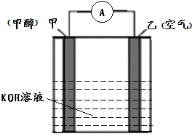
①该原电池的正极是____(填“甲”或“乙”),电解过程中乙电极附近pH____(填“增大”或“减小”);
②负极的电极反应式________________________________。
-
工业冶炼钛的第一步反应为:TiO2(s)+2C(s)+2Cl2 TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
TiCl4(g)+2CO。下列关于该反应的说法正确的是( )
A.TiCl4既是氧化产物又是还原产物
B.氧化剂与还原剂的物质的量之比为1:1
C.当转移电子数目为0.2NA时,气体体积增大1.12L
D.当有26g固体参加反应时,转移电子数目为NA
-
与淀粉相关的物质间转化关系如下图所示.其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色.

(1)B的结构简式是______.
(2)E→F的化学方程式是______.
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉 ②加热3~4min ③加入少量新制的Cu(OH)2悬浊液 ④加入少量稀硫酸⑤加热 ⑥待冷却后,滴加NaOH溶液至溶液呈碱性.则以上操作步骤正确的顺序是(填选项序号)______.
a.①②④⑤③⑥b.①④②③⑤⑥c.①④②⑥③⑤d.①⑤③④⑥②
-
与淀粉相关的物质间转化关系如下图所示.其中B的分子中含有一个甲基,B与羧酸和醇均能发生酯化反应;C的催化氧化产物既是合成酚醛树脂的原料之一,又是常见的居室污染物;E能使Br2的CCl4溶液褪色.

(1)B的结构简式是______.
(2)E→F的化学方程式是______.
(3)某同学欲验证淀粉完全水解的产物A,进行如下实验操作:①在试管中加入少量淀粉 ②加热3~4min ③加入少量新制的Cu(OH)2悬浊液 ④加入少量稀硫酸⑤加热 ⑥待冷却后,滴加NaOH溶液至溶液呈碱性.则以上操作步骤正确的顺序是(填选项序号)______.
a.①②④⑤③⑥b.①④②③⑤⑥c.①④②⑥③⑤d.①⑤③④⑥②
N2(g)+4NH3(g),己知断裂1mol N―H、N―N、N≡N分别需要吸收能量390.8kJ、193 kJ、946 kJ。则该反应的反应热△H=______kJ/mol。
4NO(g)+6H2O(g) △H=-905.5kJ/mol
2N2(g)+6H2O(g) △H=-1267 kJ/mol







