-
氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:
(1)甲醇水蒸气重整制氢
主反应:①CH3OH(g) CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
副反应:③CO(g)+3H2(g) CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g) CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
(2)实验室模拟甲醇水蒸气重整制氢过程,合成器组成n(CH3OH):n(H2O) =1:1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。
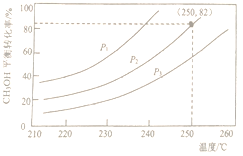
①该反应的平衡常数表达式为_______________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________。
③图中的压强由小到大的顺序是________________。
④根据主副反应分析,氢气的产率随压强的增大而___________,其原因是__________________。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,负极的电极反应式为_____。
-
氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:
(1)甲醇水蒸气重整制氢
主反应:①CH3OH(g) CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
副反应:③CO(g)+3H2(g) CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g) CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
(2)实验室模拟甲醇水蒸气重整制氢过程,合成器组成n(CH3OH):n(H2O) =1:1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。
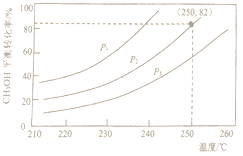
①该反应的平衡常数表达式为_______________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________。
③图中的压强由小到大的顺序是________________。
④根据主副反应分析,氢气的产率随压强的增大而___________,其原因是__________________。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,负极的电极反应式为_____。
-
甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①CH3OH(g) + H2O(g)⇌CO2(g) + 3H2(g) △H1
反应②H2(g)+CO2(g)⇌CO(g) + H2O(g) △H2=+41kJ/mol
如图表示恒压容器中0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%时的能量变化。
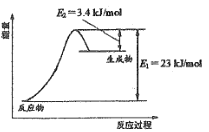
(1)计算反应①的△H1= ________。
(2)反应①能够自发进行的原因是________。升温有利于提高CH3OH转化率,但也存在一个明显的缺点是 _________。
(3)恒温恒容下,向密闭容器中通入体积比为1:1的H2和CO2,能判断反应CH3OH(g) + H2O(g)⇌CO2(g) + 3H2(g)处于平衡状态的是____________。
A.体系内压强保持不变
B.体系内气体密度保持不变
C.CO2的体积分数保持不变
D.断裂3mol H-H键的同时断裂3mol H-O键
(4)250℃,一定压强和催化剂条件下,1.00mol CH3OH 和 1.32mol H2O充分反应,平衡测得H2为2.70mol,CO为 0.030mol,则反应①中CH3OH的转化率_________,反应②的平衡常数是 _________(以上结果均保留两位有效数字)。
Ⅱ.如图是甲醇燃料电池工作示意图:
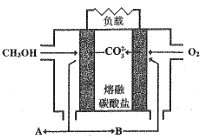
(5)当内电路转移1.5molCO32-时,消耗甲醇的质量是_________g。
(6)正极的电极反应式为 _______。
-
氢气是一种清洁能源,它的制取与应用一直是人类研究的热点。
(1)用甲醇和水蒸气在催化剂、加热条件下制氢的相关热化学方程式如下:
CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)能自发进行的原因是________。
CO2(g)+3H2(g)能自发进行的原因是________。
②将一定比例的CH3OH(g)和H2O(g)的混合气体,以相同速率通过装有不同催化剂的反应器。CH3OH转化率随催化剂的使用时长变化如图1所示,催化剂CuAl2O4与催化剂Cu/Zn/Al相比,优点有____________________。
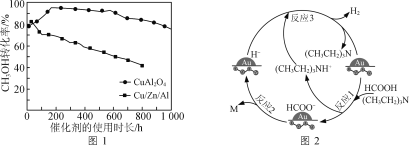
③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可获得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。为确保Cu2+、Al3+完全沉淀(浓度≤10-5 mol/L),应控制混合液pH的最小整数值为________{Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33}。
(2)用Au/ZrO2作催化剂,在(CH3CH2)3N作用下HCOOH分解制氢的原理如图2所示。反应2中生成物M的化学式为__________________,图示反应中只有氢元素化合价发生变化的是反应________(填“1”“2”或“3”)。
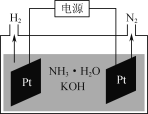
(3)如图是电解氨水和KOH混合溶液制氢的装置示意图。生成N2的电极反应式为______________。
(4)富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+,NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:__________________________。
-
甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g)  CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g)  CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
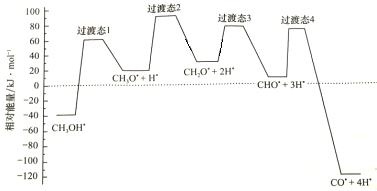
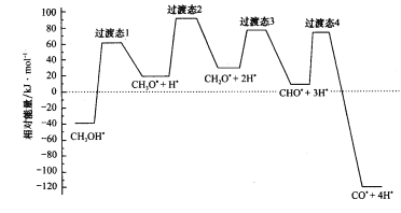
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。
(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
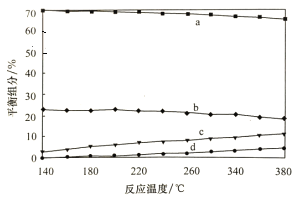
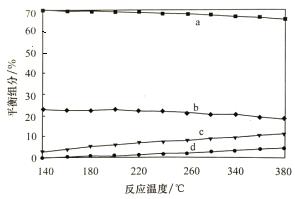
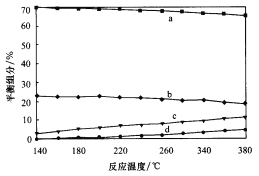
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
-
甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知甲醇分解反应:CH3OH(g)  CO(g)+2H2(g) △H1=+90.64 kJ/mol
CO(g)+2H2(g) △H1=+90.64 kJ/mol
水蒸气变换反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H2=-41.20 kJ/mol
CO2(g)+H2(g) △H2=-41.20 kJ/mol
则CH3OH(g)+H2O(g)  CO2(g)+3H2(g) △H3=____________kJ/mol
CO2(g)+3H2(g) △H3=____________kJ/mol
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为________________________________________________。

(3)在0.1MPa下,将总进料量1mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是_____________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,a、c曲线对应物质的化学式分别为_______________、______________。
(4)573.2K时,向一刚性密闭容器中充入5.00 MPa CH3OH使其分解,t h后达平衡时H2的物质的量分数为60%,则t h内v(CH3OH)=_____________MPa/h,其平衡常数分压Kp=_________。
-
甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g) CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。
(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。
(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
| 编号 | CO(mol) | H2(mol) | CH3OH(mol) |
| Ⅰ | 4 | a | 0 |
| Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。
-
甲醇与水蒸气重整制氢可直接用于燃料电池。回答下列问题:
(1)已知:甲醇分解反应:CH3OH(g) CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g)
CO(g)+2H2(g) △H1=________ kJ·mol-1水蒸气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g)
CO2(g)+H2(g) △H2=-41.20 kJ·mol-1,则CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
CO2(g)+3H2(g)△H3=+49.44kJ·mol-1。
(2)科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。此历程中活化能最小的反应方程式为_________________________。

(3)在0.1MPa下,将总进料量1 mol且n(CH3OH):n(H2O)=1:1.3的混合气体充入一刚性密闭容器中反应。
①实验测得水煤气变换反应的速率随温度的升高明显下降,原因是__________。
②平衡时,测得CH3OH的含量在给定温度范围内极小,H2、H2O(g)、CO、CO2四种组分含量与反应温度关系如图所示,试解释a的含量约是c的含量3倍的原因__________。

(4)297 K时,向密闭容器Ⅰ(体积为4L)和Ⅱ(体积为8L)中分别充入下列物质发生反应,
| 编号 | CO(mol) | H2(mol) | CH3OH(mol) |
| Ⅰ | 4 | a | 0 |
| Ⅱ | 4 | 4 | 4 |
达平衡时两个容器中c(H2)相等且c(H2)=0.5mol/L。则
①a=_____________。
②该温度时,Ⅰ中反应的K=___________。
③Ⅱ中按表格数据充入反应物此时反应的方向__________(填“正向进行”、“平衡”或“逆向进行”)。
-
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g)  CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+  O2 (g)
O2 (g)  CO2(g) + 2H2 (g) H1= —192.9kJ/mol
CO2(g) + 2H2 (g) H1= —192.9kJ/mol
H2(g)+  O2 (g)
O2 (g)  H2 O(g) H2= —120.9kJ/mol
H2 O(g) H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
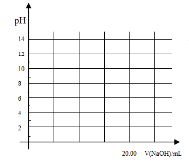
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)
-
氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g) H2(g)+
H2(g)+ O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:
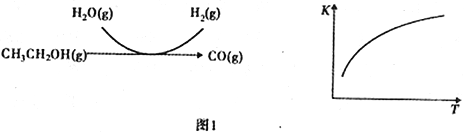
反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g) CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
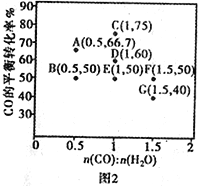
①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
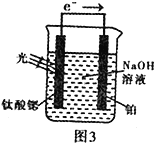
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e- O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。

















