-
(化学-物质结构与性质)
 C和Si元素在化学中占有极其重要的地位。
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
 (3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成 键和
键和 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述 键 。
键 。
-
(化学-物质结构与性质)C和Si元素在化学中占有极其重要的地位.
(1)写出Si的基态原子核外电子排布式______.
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______.
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______,微粒间存在的作用力是______.
(3)氧化物MO的电子总数与SiC的相等,则M为______(填元素符号).MO是优良的耐高温材料,其晶体结构与NaCl晶体相似.MO的熔点比CaO的高,其原因是______.
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键______.
-
C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 ____。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 ____。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ____,微粒间存在的作用力是 ____。
(3)氧化物MO的电子总数与SiC的相等,则M为 ____(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 ____。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2 的分子构型是 ________, SiO2的沸点 _______CO2的沸点(填“高于”或“低于”) ,理由是 _____________________。 CO2分子中σ键和π键的个数比为 ___________,其中心原子采取 _______杂化;
-
选做(12分)【化学—物质结构与性质】N和B元素在化学中占有很重要的地位。
(1)写出N元素基态原子的价电子排布式_______。B、N和O元素的电负性由大到小的顺序为_______.
(2)N和B两元素氟化物的化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是___________,其中BF3的分子构型为_______________。
(3)BN的晶体结构与金刚石相似其中B原子的杂化方式为_______,微粒间存在的作用力是_________。
(4)根据电子云的重叠方式判断,N2分子中存在的σ键和π键数目之比为___________。
-
(15分)C、Si、S和N元素在化学中占有极其重要的地位。
 (1)写出Si的基态原子价电子排布式 ________。
(1)写出Si的基态原子价电子排布式 ________。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ________,微粒间存在的作用力是 ________。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
 (4)SO2、NO2、H2S同属于________结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是________。
(4)SO2、NO2、H2S同属于________结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是________。
-
C和Si元素在化学中占有极其重要的地位.
(1)写出Si原子核外最外层电子排布式______. C、Si和O元素的原子半径由小到大的顺序为______.
(2)SiC的晶体结构与晶体硅的相似,微粒间存在的作用力是______.SiC晶体熔点______ 晶体硅(填<、>、=).
(3)氧化物MO的电子总数与SiC的相等,则MCl2水溶液显______性,相关的离子方程式______.
(4)C、Si为同一主族的元素,证明两者非金属性强弱的事实有______.(举一例说明)
-
【化学选修3:物质结构与性质】Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是__________,N2F2分子中N原子的杂化方式是_____________,1mol N2F2含有___________个σ键.
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N___Si-N-Si(填“>”“<”或“=”),原因是__________;
II.金属元素在现代工业中也占据极其重要的地位,钛也被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大,是宇航、航海、化工设备等的理想材料。
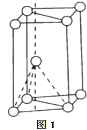
(4)基态钛原子核外共有________种运动状态不相同的电子.金属钛晶胞如下图1所示,为_______堆积(填堆积方式).

(5)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2.化合物乙的沸点明显高于化合物甲,主要原因是_____________;化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为_____________;
(6)钙钛矿晶体的结构如图3所示.假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被________个氧离子包围。
-
【化学—选修3:物质结构与性质】
I.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是________,N2F2分子中N原子的杂化方式是____________,1mol N2F2含有______个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N—Si—N________Si—N—Si(填“>”“<”或“=”),原因是_________。
II.金属元素在现代工业中也占据极其重要的地位,钛被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大特点,是理想化工设备材料。
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图1所示,为_______
堆积(填堆积方式)。
4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是_______。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________。
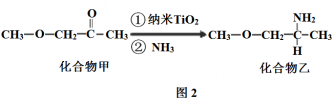

(5)钙钛矿晶体的结构如图3所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围。
-
(13分)【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为________:________。
-
【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式________。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为________。

C和Si元素在化学中占有极其重要的地位。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
键和
键,SiO2中Si与O原子间不形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
键 。



