-
【化学一物质结构与性质】
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个 周期中.对它们的性质及结构的描述如下.
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排 布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其 第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周 期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全 部充满,但并不是第IA族元素.
(1)请写出E原子基态的电子排布式________.
(2)A与C形成的最简单化合物(甲)分子的立体结构是________,其中C原子的杂化方式是________.
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)________原因是________.
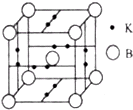
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效 杀灭癌细胞,有望成为癌症治疗药物的候选材料.它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶 点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为________.
-
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望 成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。

-
【化学——物质结构与性质】选做(15分)X、Y、Z、L四种元素分别位于周期表中三个紧邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。该原子核外电子排布式是 。其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体,1mol该化合物含有的化学键数目为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个σ键, 个π键
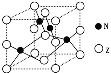
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。
-
【化学——选修3:物质结构与性质】(15分)X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是 。
该原子核外电子排布式是 。
其最高正价氧化物对应的水化物的化学式是 和 。
(2)元素X与Y形成的化合物晶体类型是 晶体
1mol该化合物含有的化学键数为 (用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是 ,该化合物中X原子的杂化轨道类型是 。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有 个δ键, 个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为 。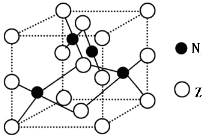
-
【化学—选修3:物质结构与性质】
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子,L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是_______________,该原子核外电子排布式是_______________,其最高正价氧化物对应的水氧化物的化学式是_______________;
(2)元素X与Y形成的化合物晶体类型是晶体_________,1mol该化合物含有的化学键数为___________(用阿伏加德罗常数NA 表示);
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是________,该化合物中X的原子的杂化轨道类型是____________;
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个____δ键,____个π键;
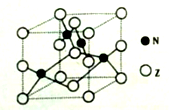
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为______。
-
[化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 | A | B | C | D |
结构性质
信息 | 基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
(1)写出D原子的外围电子排布式______,A、B、C、D四种元素的第一电离能最小的是______(用元素符号表示).
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点______(填“高”或“低”).
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
| A-O | A=O | F-O | F=O |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
在A和O之间通过双键形成AO2分子,而F和O则不能和A那样形成有限分子,原因是______.
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是______(填序号).a.离子键 b.极性键c.非极性键d.配位键 e.金属键
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.
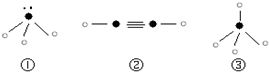
则在以上分子中,中心原子采用sp3杂化形成化学键的是______(填序号);在②的分子中有______个σ键和______个π键.
(6)已知一种分子B4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B4(g)═2B2(g)△H=______KJ/mol.
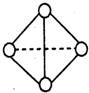
-
〔化学—选修3:物质结构与性质〕(15分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32 -离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。
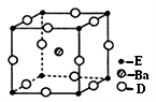
纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
-
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
元素 结构或性质信息
A 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键
B 原子核外M层电子数是N层电子数的4倍
C 是使用最为广泛的合金的主要成分
D 原子各内层电子均已饱和,最外层电子数为1
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____________,D元素原子的外围电子排布式为________
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____________。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____________,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____________,与B离子最近且等距的A离子的个数为________。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为____(可用根号表示)。
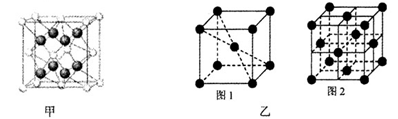
-
四种短周期元素A、B、C、D原子序数依次递增,原子半径大小: B>C>D>A,四种元素之间两两形成的三种18电子结构的分子,它们的球棍模型及部分性质如下表:
| 甲 | 乙 | 丙 |
| 
| 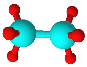
| 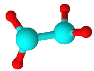
|
| 无色液体,具有强氧化性,可用作消毒剂 | 标况下密度约为1.34g/L,天然气中的成分之一 | 液态,具有强还原性,用作火箭推进的燃料 |
(1)写出化学式:甲___________、丙_____________。
(2)元素B核外有________种能量不同的电子,其形成的单质晶体可能是__________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(3)已知1g 液态丙与足量液态甲反应生成氮气和水蒸气,并放出20.05kJ的热量,写出反应的热化学方程式________________。
(4)配平亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式:
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O。
(5)该反应过程较复杂,一般认为分以下几步:
①IO3-+SO32-IO2-+SO42-(反应慢)
②IO2-+2SO32-I-+2SO42-(反应快)
③5I-+6H++IO3-3I2+3H2O(反应快)
④I2+SO32-+H2O2I-+SO42-+2H+(反应快)
根据上述条件推测,此反应速率由________步(填序号)反应决定。
(6)若预先加入淀粉溶液,由反应过程看,必在_______离子消耗完时,才会有溶液变蓝的现象产生。原因是_____________________。
-
科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
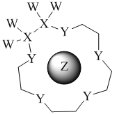
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X












