-
某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用。他们进行了两组实验,过程如下:
过程Ⅰ:
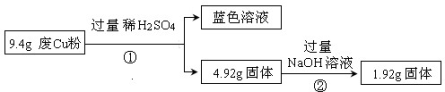
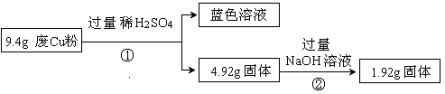
过程Ⅱ:
(1)废Cu粉中一定含有的杂质是___________________(填化学式);
(2)写出过程①③中可能发生的所有反应的离子方程式:
①_______________________________________;
③_______________________________________;
(3)综合过程Ⅰ、II,计算该9.4g废Cu粉中,m(SiO2)=_________,m(Cu)= _________;
-
某科研小组探究工业废Cu粉(杂质可能含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用。他们进行了两组实验,过程如下:
Ⅰ:
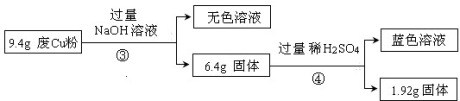
Ⅱ:
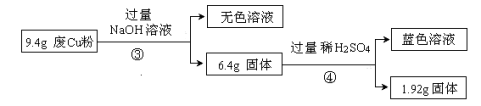
(1)废Cu粉中含有的杂质是 。
(2)分别写出过程①③中发生反应的离子方程式:
① 。
③ 。
(3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是 (可不必化简)。、
(4)已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
从Ⅱ中所得蓝色溶液中分离提纯得到CuSO4·5H2O晶体,需要经过下列步骤:
a、向蓝色溶液中加入一定量的H2O2 溶液;
b、调节溶液的pH为 之间;
c、然后过滤、结晶,再过滤,可得CuSO4·5H2O
下列关于实验操作的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.上述步骤c中第一次过滤是为了得到滤液,第二次过滤是为了得到固体
D.在pH >4的溶液中Fe3+一定不能大量存在
-
硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质。工业上按以下流程用硅藻土制备纳米二氧化硅。

(1)煅烧硅藻土的目的是__。
(2)在加热条件下加入烧碱时反应的化学方程式为__。
(3)加入过量硫酸后生成胶体的反应方程式为_________。
-
硅藻土是由无定形SiO2组成的,含有少量Fe2O3、Al2O3及有机物等杂质,通常呈浅黄色或浅灰色,质软多孔。工业上可按如图所示流程,用硅藻土制备纳 米级二氧化硅。

请回答下列问题:
(1)煅烧硅藻土的目的是___________。
(2)在加热条件下加入烧碱溶液时,发生反应的化学方程式为___________、__________。
(3)加入过量硫酸后,生成沉淀的离子方程式为_________。
(4)若用纳米级二氧化硅制成水溶液,则该溶液所具有的性质与下列图片有关的是________(填字母)。

-
工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。

(1)图示中(1)的实验操作是________;图示中(2)加入的试剂__________。
(2)试写出下列物质(或溶液中的溶质)的化学式:
B__________________;C__________________;H________________;F______________。
(3)写出化学方程式:
①_____________________________________。
③_____________________________________。
④_________________________________。
-
下表中括号内的物质是杂质,试将除杂试剂填入表中:
| (1) | (2) | (3) | (4) | (5) |
| 混合物 | CO (CO2) | Fe2O3 (Al2O3) | SiO2 (NaCl) | FeSO4 (CuSO4) | NaHCO3 (Na2SiO3) |
| 除杂试剂 | _____ | _____ | _____ | _____ | _____ |
-
已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是
A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O
B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3
C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1
D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a
-
经精选后的铝土矿A(主要成份为Al2O3,含有一定量的Fe2O3、SiO2杂质),可用A来制备电解铝原料——氧化铝,某课外小组同学模拟该过程,设计了如下方案:

请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __
-
实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
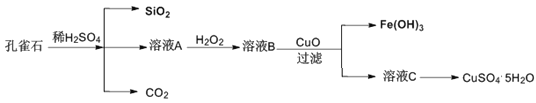
请回答下列问题:
(1)溶液A的金属离子有Fe3+和______________。
(2)溶液A中加入H2O2的目的是______________,发生的离子方程式为_____________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、______________、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为________________________。
-
工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。










