-
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
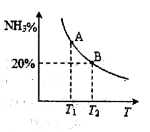
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
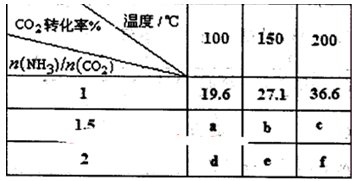
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。
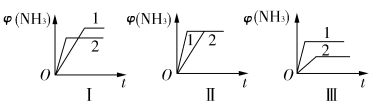
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·K-1 ·mol-1
该反应在常温下能否自发进行?________(填“能”或“不能”)。
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=________。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式________。
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
2NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平
衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,
原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后
测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1=________。
若温度为400℃,平衡常数为K2,则K1________K2(填“<”、“=”或“>” )
(3)甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g);△H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)== H2O(l);△H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g);△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g)+ 2H2O(l);△H3=-890.3kJ/mol
H2O(g)== H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式。
②CH4(g)+H2O(g)=CO(g)+3H2(g); △H=kJ/mol
-
I.科学家一直致力于“人工固氮”的新方法研究.
(l)目前合成氨技术原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol
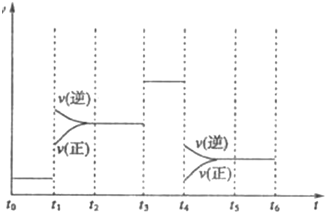
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为________;t1时刻改变的反应条件是________.
②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是________ (填序号).
a. b.
b. c.c(H+).c(OH-)d.
c.c(H+).c(OH-)d.
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式________.
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)⇌4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a________ 0,△S________ 0,(填“>”“<”或“=”).
②已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=________.
-
科学家一直致力于“人工固氮”的新方法研究。目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g);△H=—92.4kJ·mol—1。在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.点d和点e处的n(N2)不相同
D.点e反应达到化学平衡状态,反应停止
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.

(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时各物质的浓度分别为c(H2)=9.00mol/L,c(N2)=3.00mol/L,c(NH3)=4.00mol/L,此温度下该反应的平衡常数为______.
(2)三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数随时间的变化如图所示.下列说法正确的是______(填序号).
A.图I可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ一定是在同温同压下不同催化剂对反应的影响,且催化剂效果1>2
(3)将水蒸气通过红热的炭即产生水蒸气,化学方程式为:C(s)+H2O(g) H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
(4)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)⇌3NH3(g),△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x.则K和x的关系满足K=______.若温度为400℃,平衡常数为K2,则K1______K2(填“<”、“=”或“>”)
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.
①写出CO燃烧的热化学方程式______.
②2H2(g)+O2(g)═2H2O(g)△H=______kJ/mol.
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)
 3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=______.
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1=________。若温度为400℃,平衡常数为K2,则K1________K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)== H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g) ;△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g) + 2H2O(l); △H3=-890.3kJ/mol
H2O(g) == H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H=kJ/mol
2NH3(g)
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。

H2O(1)+CO(NH2)2(1) △H,



