-
(8分)铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
-
铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) + O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
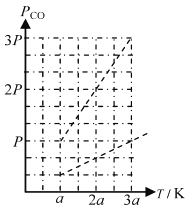
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。
-
铁是世界上用量最大的金属,铁及其化合物在生活、生产中有广泛应用。
请回答下列问题:
⑴ Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为 。34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为 mol。
⑵ FeCl3溶液是一种黄色透明液体,可用作止血剂,其原因是
;向煮沸的蒸馏水中加入几滴饱和FeCl3溶液,继续煮沸得到红褐色的Fe(OH)3胶体,鉴别FeCl3溶液与Fe(OH)3胶体的方法是 。
⑶ 高铁酸钠(Na2FeO4)是一种绿色水处理剂,具有杀菌消毒和聚沉水中杂质的作用,它的杀菌消毒原理是 。高铁电池是一种新型可充电电池,高铁电池的总反应为3Zn+2Na2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为 。
3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为 。
⑷ 铁红是一种重要的红色颜料,其主要成分是Fe2O3,将一定量的铁红溶于130mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L气体(标准状况),向反应后溶液中加入几滴KSCN溶液,溶液不变红色,则参加反应的铁粉质量为 。
-
铁是世界上用量最大的金属,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为______________________________;34.8g Fe3O4与足量稀硝酸反应,被还原的HNO3物质的量为____________mol。
(2)FeCl3溶液是一种黄色透明液体,可用作止血剂,其原因是__________________;向煮沸的蒸馏水中加入几滴饱和FeCl3溶液,继续煮沸得到红褐色的Fe(OH)3胶体,鉴别FeCl3溶液与Fe(OH)3胶体的方法是__________________________________________________________________。
(3)高铁酸钠(Na2FeO4)是一种绿色水处理剂,具有杀菌消毒和聚沉水中杂质的作用,它的杀菌消毒原理是________________________________________;高铁电池是一种新型可充电电池,高铁电池的总反应为3Zn+2Na2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为___________________。
3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为___________________。
(4)铁红是一种重要的红色颜料,其主要成分是Fe2O3,将一定量的铁红溶于130mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L气体(标准状况),向反应后溶液中加入几滴KSCN溶液,溶液不变红色,则参加反应的铁粉质量为__________。
-
铬是一种重要的金属元素,具有多种价态,单质铬是硬度最大的金属,熔点为 。回答下列问题:
。回答下列问题:
 工业上以铬铁矿
工业上以铬铁矿 主要成分是
主要成分是 为原料冶炼铬的流程如图所示:
为原料冶炼铬的流程如图所示:

 中铬元素的化合价为_________。
中铬元素的化合价为_________。
 高温氧化时发生反应的化学方程式为________________。
高温氧化时发生反应的化学方程式为________________。
 操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
操作a由两种均发生了化学反应的过程构成,其分别是_________、铝热反应。
 是两性氢氧化物,请写出其电离方程式_________________。
是两性氢氧化物,请写出其电离方程式_________________。
 铬元素能形成含氧酸及含氧酸盐,若测得浓度为
铬元素能形成含氧酸及含氧酸盐,若测得浓度为 的铬酸
的铬酸 溶液中含铬元素的微粒浓度分别为
溶液中含铬元素的微粒浓度分别为 、
、 、
、 ,试推测
,试推测 溶液呈________
溶液呈________ 填“酸”“碱”或“中”
填“酸”“碱”或“中” 性,原因是______________。
性,原因是______________。
 水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
水中的铬元素对水质及环境均有严重的损害作用,工业上用下述方法来进行无害化处理并获得有价值的产品。
 电解处理含有
电解处理含有 的污水:用铁作电极电解污水,
的污水:用铁作电极电解污水, 被阳极区生成的离子还原成
被阳极区生成的离子还原成 ,生成的
,生成的 与阴极区生成的
与阴极区生成的 结合生成
结合生成 沉淀而除去。则阴极上的电极反应式为_______,若要处理
沉淀而除去。则阴极上的电极反应式为_______,若要处理 浓度为
浓度为 的污水,理论上需要消耗_______kg的铁。
的污水,理论上需要消耗_______kg的铁。
 转化为有价值的产品磁性铁铬氧体
转化为有价值的产品磁性铁铬氧体 :先向含
:先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气 氧化部分
氧化部分 并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式__________,若处理含
的离子方程式__________,若处理含 不考虑其他含铬微粒
不考虑其他含铬微粒 的污水时恰好消耗
的污水时恰好消耗 ,则当铁铬氧体中
,则当铁铬氧体中 时,铁铬氧体的化学式为_______________。
时,铁铬氧体的化学式为_______________。
-
(14分)工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
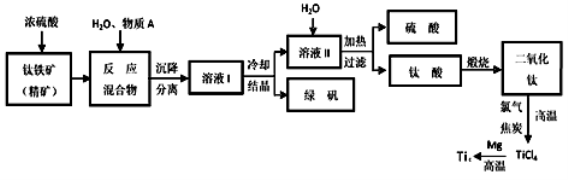
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ•mol-1 TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
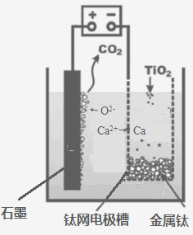
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) _________。
-
工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
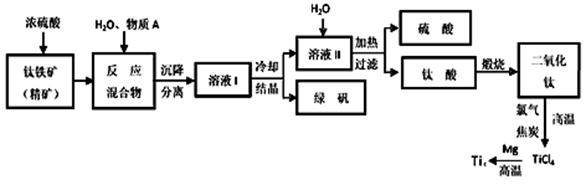
回答下列问题:
(1)钛铁矿和浓硫酸反应属于______________________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_______________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。①写出阳极所发生反应的电极反应式:________________________________。
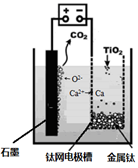
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)________。
-
Fe元素是地壳中最丰富的元素之一,在金属中含量仅次于铝,铁及其化合物在生活生产中有广泛应用。请回答下列问题。
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO 3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
3Fe+4CO2,若有1 mol Fe3O4参加反应,转移电子的物质的量是________ mol。
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是___________________________________________________。
(3)某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。
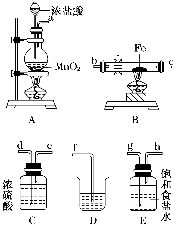
请回答下列问题:
①各装置的正确连接顺序为(填写装置代号)
A→________→________→________→D。
②装置C的作用是_______________________________________________________。
③反应开始后,B中硬质玻璃管内的现象为________;可以检验生成物中含有Fe3+的试剂是________(填写试剂名称)。
-
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO 3Fe+4C02,若有1mol
3Fe+4C02,若有1mol
Fe304参加反应,转移电子的物质的量是________mol.
 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
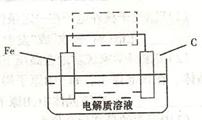
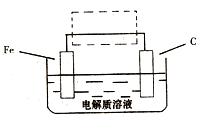
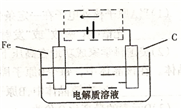
(3)钢铁的电化腐蚀简单示意图如下,将该图稍作修
改即可成为钢铁电化学防护的简单示意图,请在下图虚
线框内作出修改,并用箭头标出电子流动方向。
(4)硫酸亚铁晶体(FeS04·7H20)常作医药上的补血剂。课外研究性小组测定该补血剂中铁元素的含量。实验步骤如下:
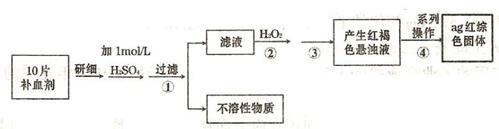
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,此过程的现象为:
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=________(已知溶液中离子浓度小于10-5mol)时,该离子可看做沉淀完全;lg2=0.3)
③步骤④中一系列的操作步骤为:过滤、________、灼烧、冷却、称量。
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质
量为________g.(用含a的式子表示)
-
Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe34+4CO 3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;
3Fe+4C02,若有1mol Fe34参加反应,转移电子的物质的量是______mol;
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是______;
(3)钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向______;
(4)硫酸亚铁晶体常作医药上的补血剂.课外研究性小组测定该补血剂中铁元素的含量.实验步骤如下:
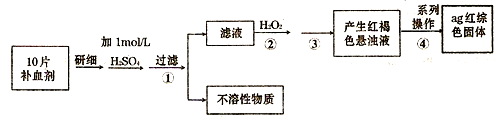
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加H2O2,此过程的现象为:______;
②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=______(已知溶液中离子浓度小于10-5mol时,该离子可看做沉淀完全;lg2=0.3);
③步骤④中一系列的操作步骤为:过滤、______、灼烧、冷却、称量;
④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质量为______g.(用含a的式子表示)
3Fe(s)+4CO2
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol







 (2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________
(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是________


