-
(本题共13分)氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:
4NH3(g) +5O2(g) 4NO(g)+6H2O(g)+Q,完成下列填空:
4NO(g)+6H2O(g)+Q,完成下列填空:
23.如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
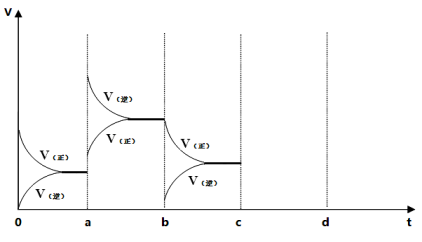
24.在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是 ,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是 ,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像。
25.工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图。
26.氨中氮元素原子最外层电子排布的轨道表达式是 ,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示) 。
27.已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 。
-
氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:4NH3(g) +5O2(g)⇌4NO(g)+6H2O(g)+Q,完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是___________________
a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
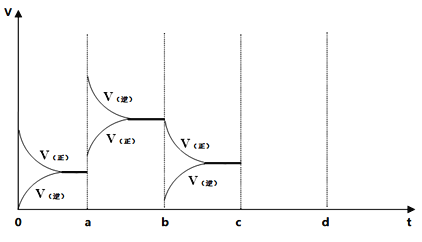
(2)在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是____________,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b____c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是____________,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像________。
(3)工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图________
(4)氨中氮元素原子最外层电子排布的轨道表达式是______________,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 _______________。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示)_____________。
(5)已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 __________________。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 ______________
-
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-1025kJ/mol
氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)•c(O2)=c(NO)•c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施
-
(本题共14分)中学化学中有许多与氮有关的反应。阅读材料,回答问题。
1.氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2→4NO+6H2O完成下列计算:
①生成1molNO消耗氧气的体积为 L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为_____mol/L。
③.如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3十3O2→2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。
2.已知真空管中反应2NO2 N2O4,现向一真空管中充入4L标况下的NO2 气体:
N2O4,现向一真空管中充入4L标况下的NO2 气体:
① 若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol
若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
② 将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
3.各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→ NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;②混合气体中V(NO):V(NO2)= 。
-
硝酸是重要的化工原料,工业上用氨催化氧化法生产硝酸,反应如下:
①氧化炉:4NH3+5O2=4NO+6H2O
②吸收塔:4NO+3O2+2H2O=4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80。完成下列计算:
(1)1mol NH3完全转化为NO至少需要空气______mol。工业上先将氨气和空气混合好,在氧化炉反应后直接通入吸收塔中用冷水吸收,为了确保吸收效果,第②步反应要求氧气至少过量20%,计算起始时空气与氨气的体积比至少为______
(2)硝酸工业产生的氮氧化物尾气(NO和NO2),可用烧碱吸收,反应如下:
①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO3+NaNO2+H2O
现有含0.5mol氮氧化物的尾气,用8mol/L的NaOH溶液完全吸收,吸收后的溶液中c(OH﹣):c(NO2﹣):c(NO3﹣)=5:4:1。所用NaOH溶液的体积为______mL。若将尾气中NO与NO2的平均组成记为NOx,则x=______
(3)工业上用硝酸与氨气反应制取硝酸铵:HNO3+NH3=NH4NO3,反应时NH3的吸收率为97%,硝酸的利用率为98%。在用氨气制取硝酸时,氨气的利用率为90%。计算生产80吨的硝酸铵共需氨气__吨?(保留1位小数)
-
氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
-
氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
-
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863 计划。
(1)催化剂常具有较强的选择性。已知:
反应I:4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H1=-905kJ·mol-1
4NO(g)+6H2O(g) △H1=-905kJ·mol-1
反应II:4NH3(g)+3O2(g)  2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
写出NO 分解生成N2与O2的热化学方程式______________________________________。
(2)N2O也可分解生成N2与O2。在四个恒容密闭容器中按左下表相应量充入气体,发生2N2O(g) 2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
2N2(g)+O2(g),容器I、II、III中N2O平衡转化率如下图所示。
| 容器 | 容积/L | 起始物质的量/mol |
| N2O | N2 | O2 |
| I | V1 | 0.1 | 0 | 0 |
| II | 1.0 | 0.1 | 0 | 0 |
| III | V2 | 0.1 | 0 | 0 |
| IV | 1.0 | 0.06 | 0.06 | 0.04 |
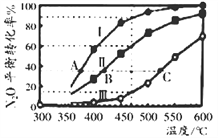
①该反应的△H_________0(填“>”、“=”、“<”);
②图中A、B、C 三点处容器内的总压强,由大到小的顺序是_____________________;
③容器IV在470℃进行反应时,起始速率:v(N2O)正____v (N2O)逆(填“>”、“=”、“<”)。
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在20L密闭容器中充人lmolNH3和2molO2,测得一定时间内有关物质的量关系如图:
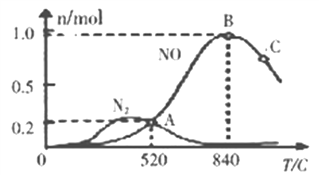
①该催化剂在低温时选择反应________(填“I”或“II”)。
②C点比B点所产生的NO的物质的量少的原因可能是_________________________________。
-
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)  4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)  2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
| 化 学 键 | H—O | O=O | N≡N | N—H |
| 键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是_________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
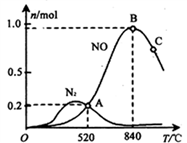
① 该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2 4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有______________
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:
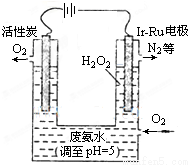
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)______c(NO3﹣)(填“>”、“<”或“=”).
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为______.
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为______.
-
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)  4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)  2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
| 化 学 键 | H—O | O=O | N≡N | N—H |
| 键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是_________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O) 时,说明反应已达平衡
C.当容器内 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.当测得容器内的O2密度不再变化时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

① 该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2 4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=__________ ( 不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有______________
A.使用催化剂Cu/TiO2 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图:

①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)______c(NO3﹣)(填“>”、“<”或“=”).
②Ir﹣Ru惰性电极有吸附O2作用,该电极上的反应为______.
③理论上电路中每转移3mol电子,最多可以处理NH3•H2O的物质的量为______.
4NO(g)+6H2O(g)+Q,完成下列填空:


 2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1
2N2(g)+6H2O(g) △H2=-1266.6kJ·mol-1




