-
某小组同学欲探究0.1 mol/L Fe3+溶液与 0.1 mol/L S2-溶液的反应。小组同学先进行理论预测,提出如下三种可能:
a.Fe3+与 S2-发生复分解反应
b.Fe3+与 S2-发生 反应
c.Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式
(2)将预测b补充完整 ,说明预测依据 。
在进行实验验证前,先进行资料收集,得到如下信息:
物质
颜色
水中溶解性
Fe2S3
黑色
难溶于水
FeS
黑褐色
难溶于水
进行如下实验:
实验步骤
操作
现象
备注
1
向2 mL 0.1 mol/L氯化铁溶液中逐滴滴入3滴0.1 mol/L 硫化钠溶液
产生黑色沉淀, 立即变为黄色沉淀,未见其它明显现象
自始至终都未见红褐色沉淀
2
继续滴加3滴0.1 mol/L 硫化钠溶液
同上
3
继续滴加0.1 mol/L 硫化钠溶液至过量
产生黑色沉淀,振荡后静置,未发现明显变化
(3)写出黑色沉淀转变为黄色沉淀的离子方程式
为进一步探究反应实质,该组同学进行了如下实验:
实验步骤
操作
现象
4
向2 mL 0.1 mol/L硫化钠溶液中逐滴滴入3滴0.1 mol/L 氯化铁溶液
产生黑色沉淀,未见其它明显现象
5
继续滴加3滴0.1 mol/L 氯化铁溶液
同上
6
继续滴加0.1 mol/L 氯化铁溶液至过量
同上
(4)步骤4与步骤1现象不同的原因可能是
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS。请判断他的想法是否合理并说明理由
(6)依据以上实验现象,可得出结论:_________________________。
高三化学实验题困难题查看答案及解析
-
某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
编号
操作
现象
Ⅰ
先向2mL0.1mol•L﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水
___________________
___________________
Ⅱ
先向2mL0.1mol•L﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L﹣1KI溶液
滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L﹣1KI溶液后,血红色无明显变化
实验Ⅰ中发生反应的离子方程式为 , .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
编号
操作
现象
Ⅲ
向2mL0.1mol•L﹣1KI溶液中滴加1mL
0.1mol•L﹣1FeCl3溶液,再滴加KSCN溶液
滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由: .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
编号
操作
预期现象及结论
Ⅳ
向2mL0.1mol•L﹣1KI溶液中滴加1mL 0.1mol•L﹣1
FeCl3,溶液变黄色,取该溶液于两支试管中,
试管①中滴加 ,
试管②中滴加 .
预期现象① ,
② .
结论 .
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为: .
高三化学实验题困难题查看答案及解析
-
某研究性学习小组为探究 Fe3 + 与 Ag 反应,进行如下实验:
将适量的0.1 mol/L Fe(NO3)3 溶液加入到新制备的银镜中, 发现银镜溶解,同时无其它固体物质析出。
甲同学认为:Fe3+ 具有氧化性, 能够溶解单质Ag。
乙同学认为:Fe(NO3)3 溶液显酸性,该条件下NO3- 也能氧化单质Ag。
(1)Fe(NO3)3 溶液显酸性的原因 。(请用离子方程式表述)
(2)乙同学设计下述实验以支持其观点, 请填写下表内容
实验步骤(不要求写具体操作过程)
预期现象和结论
步骤I: ① 。
步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、
c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中。
② ,乙同学的推测
成立;反之,则不成立。
(3)甲同学通过验证产物,证实了Fe3+ 能够氧化单质 Ag,请帮助甲同学写出实验方案 (要求:写出实验操作、现象和结论)。
(4)丙同学进一步研究 Fe3+ 与Ag反应的程度。按下图连接装置并加入药品(盐桥中的物质不参与反应)。

① K闭合时,指针向左偏转,石墨作 (填“正极”或“负极”)。
② 当指针归零后,向左侧U型管中滴加几滴 FeCl2 浓溶液,发现指针向右偏转,写出此时银电极的反应式 。
③ 结合上述实验分析,写出Fe3+ 和Ag反应的离子方程式 。
④ 丙同学进一步验证其结论:当指针归零后,向右侧U型管中滴加数滴饱和NaCl溶液,可观察到的现象是 。
高三化学实验题困难题查看答案及解析
-
某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
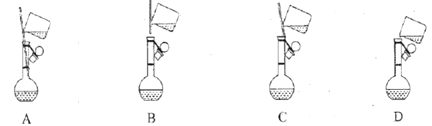
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
高三化学实验题困难题查看答案及解析
-
化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯
现象

编号
溶液x
I
0.1mol/LFe(NO3)2,pH≈l
溶液黄色立即加深,30秒后溶液变为褐色,无浑浊
Ⅱ
KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1
1小时内溶液颜色始终保持无色
Ⅲ
0.1mol/LAgNO3
迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI)
IV
0.1mol/LCu(NO3)2
5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI)
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。

(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
高三化学实验题中等难度题查看答案及解析
-
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化.
(1)该同学最初的实验操作和现象如下:
①实验I的现象为______.编号 操作 现象 I 先向2mL 0.1mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 II 先向2mL 0.1mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1mol/L KI溶液 滴加KSCN溶液后,溶液变成红色;滴加KI溶液后,红色无明显变化
②FeCl2溶液与新制氯水反应的离子方程式为______.
(2)该同学分析了导致实验II现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
根据实验III,甲同学认为Fe33+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由______.编号 操作 现象 III 向2mL 0.1mol/L KI溶液中滴加1mL 0.1mol/L FeCl3溶液,再滴加KSCN溶液 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成红色
(3)该同学认为需要进一步设计实验证明根据实验III中现象得出的结论.请补全下表中的实验方案.
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同.该同学结合上述实验结论,分析了实验III中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为______.编号 操作 预期现象及结论 IV 向2mL 0.1mol/L KI溶液中滴加1mL0.1mol/L FeCl3溶液, ______ 高三化学解答题中等难度题查看答案及解析
-
某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】

已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2−反应直接生成沉淀Fe2S3。ⅱ.Fe3+被S2−还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作
现象
取少量FeS固体,加入稀盐酸
固体溶解,有臭鸡蛋气味气体生成
取少量Fe2S3固体,加入稀盐酸
固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成
根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L− 1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤
操作
现象
I
开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体
II
继续滴加Na2S溶液
一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失
(4)进一步实验证实,步骤 I 中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤 I 中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
高三化学实验题困难题查看答案及解析
-
某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号
操作
现象
实验Ⅰ
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5∼6滴(混合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2mL实验Ⅰ反应后的溶液,滴加2滴0.1mol⋅L−1 KSCN溶液
溶液呈红色
(1)证明实验Ⅰ中有Fe2+ 生成,加入的试剂为____________________________。
(2)写出实验Ⅰ反应的离子方程式:_____________________________________。
(3)上述实验现象可以证明Fe3+与I−发生可逆反应,实验Ⅰ在用量上的用意是__________
(4)在实验I的溶液中加入CCl4,实验现象是____________________________,取其上层清液中滴加KSCN溶液,并未看到明显的红色,其原因为(从平衡移动的角度解释)_________________________________________________________。
(深入探究)20min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(5)已知在酸性较强的条件下,I−可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I−氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:____________________________________,20min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是__________________________。
高三化学实验题困难题查看答案及解析
-
某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号
操作
现象
实验Ⅰ
取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液
溶液呈红色
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
高三化学实验题困难题查看答案及解析
-
某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号
操作
现象
实验Ⅰ
取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5)
溶液变为棕黄色
实验Ⅱ
取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液
溶液呈红色
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
高三化学实验题困难题查看答案及解析