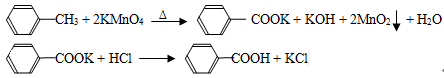-
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
 +2KMnO4
+2KMnO4
 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
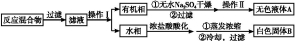
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, ________ | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中, ________ | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, ________ | ________ | 白色晶体 是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
-
苯甲酸(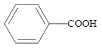 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯( )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4
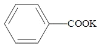 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl
 +KCl
+KCl
相关物质的部分信息如下表:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /g•mL-1 | 溶解度 |
| 4℃冷水 | 75℃热水 |
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
实验装置(部分夹持装置已略去)和流程如下:
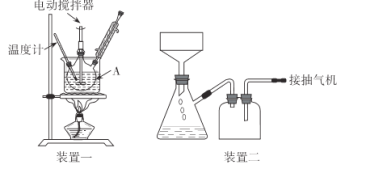
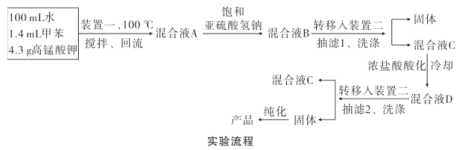
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。
-
苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。主要实验装置(回流搅拌装置)如图所示:
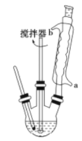
反应原理:
 +2KMnO4→
+2KMnO4→ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl→
+HCl→ +KCl
+KCl
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
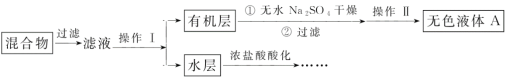
(1)无色液体A的结构简式为___,操作Ⅱ为___;
(2)如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是___,写出该反应的离子方程式:___;
(3)冷却水应该从冷凝管___(填“a”或“b”)口流入;
(4)要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(5)纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
-
(17分)(2012•广东)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
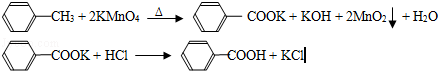
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
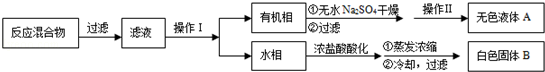
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为 ,操作Ⅱ为 .
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
| ③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10﹣3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字).
-
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理:
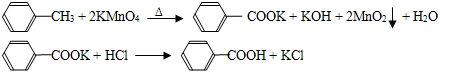
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
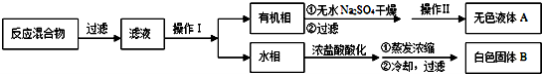
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解, | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体, | | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。
-
(10分).苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
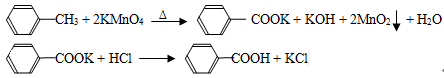
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
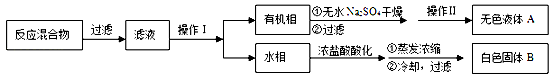
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解, | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
| ③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为 (保留二位有效数字)。
-
(11分)苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
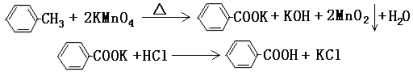
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
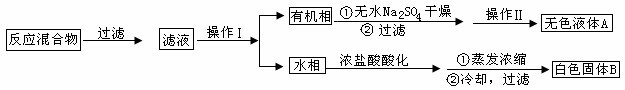
已知:苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热,溶解,Ⅰ | 得到白色晶体和无色溶液 | ———— |
| ② | 取少量滤液于试管中, Ⅱ | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体, Ⅲ | Ⅳ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol。产品中苯甲酸质量分数为 (保留两位有效数字)。
-
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
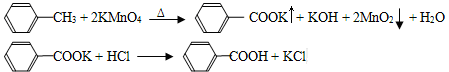
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。

(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
| A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 | |
| ② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
| | 第一次 | 第二次 | 第三次 | 第四 |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。
-
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸。反应方程式如下:
 +2KMnO4
+2KMnO4
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl→
+HCl→ +KCl
+KCl
已知有关化合物的相关数据如表所示:
| 化合物 | 相对分子质量 | 密度(g/cm3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | — | 易溶于水 | — |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
苯甲酸在100g水中的溶解度0.18g(4℃),0.27g(18℃),2.2g(75℃)。
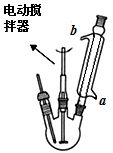
合成:如上图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾。经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物。
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④_________→⑤过滤→⑥洗涤→⑦干燥。
请回答下列问题:
(1)实验室中量取4.23mL甲苯所需仪器为_________。
(2)冷凝管的上口是否需要塞上塞子________(填“是”或“否”),a处水流方向是_______(填“进水”或“出水”)。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由_________。
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是_________;“④”的操作名称是________;可证明“⑥洗涤”步骤已洗涤干净的方法是_____________。
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为________。
-
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:
C6H5-CH3+2KMnO4 → C6H5-COOK+KOH+2MnO2↓+H2O
甲苯 苯甲酸钾
C6H5-COOK+HCl → C6H5-COOH+KCl
苯甲酸
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;
苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】30.0 mL甲苯和25.0 mL 1 mol·L-1
高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)冷凝管的进水口为__________(填“a”或“b”)
(2)在本实验中,三颈烧瓶最合适的容积是________(填字母)
A.50 mL B.100 mL C.200 mL D.250 mL
【分离产品】他们设计如下流程分离粗产品苯甲酸和回收甲苯:
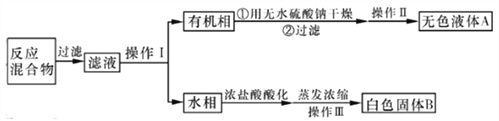
(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_______。
(4)操作Ⅲ的名称是____。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
+2KMnO4
+KOH+
+HCl
+KCl

 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯( +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O