-
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
(1)①5分钟时O2的反应速率是_________;
②列式并计算该条件下反应的平衡常数K=___________。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率_______(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____________。(填字母)
A.SO2和SO3浓度相等
B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
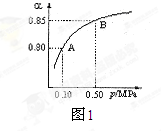
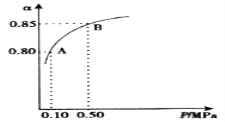
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___________K(B)(填“>”、“<”或“=”)。
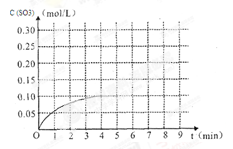
(3)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
-
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1) 某温度下,将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得混合气体压强为原来的3/4,计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2(10分)有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;左、右;增大、减小、不变)。

⑴达到平衡所需要的时间:t(A)________t(B),
⑵达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向________反应方向移动,B中的化学反应速率________。
⑶达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量________,B容器中SO2的百分含量________。
-
(12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等 b. SO2百分含量保持不变
c. 容器中气体的压强不变 d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
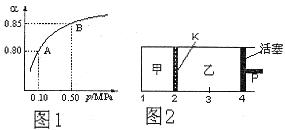
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
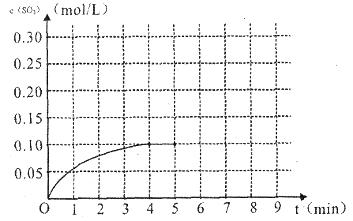
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
-
硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。
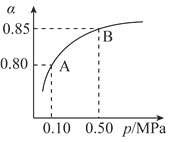
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
-
硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。
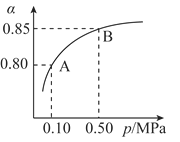
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
-
硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)  2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)  2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下, SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。
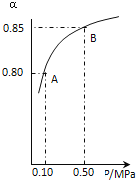
2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
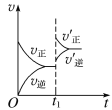
①tl 时刻达到平衡后,改变一个条件使化学反应速率发生如下图所示的变化,则改变的条件是________。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,n(SO3)的取值范围是_____________。
-
硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是__。
| SO2压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2molSO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”、“<”或“=”),B点的化学平衡常数是__。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①tl时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是__。
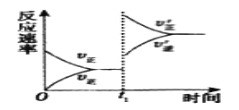
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20molSO2和0.10molO2,则平衡__移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,_mol<n(SO3)<_mol。
-
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2 和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K=。
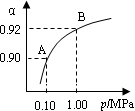
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa)________K(1.0 MPa)。
-
二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
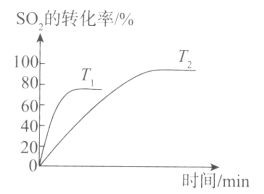
①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:
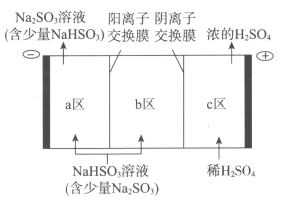
i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
-
钠、镁、铝三种金属单质的混混合物跟足量的稀硫酸溶液充分反应后,得到标准状况下的氢气2.24L,则这三种金属的总物质的量可能是
A.0.050 mol B.0.060 mol C.0.100 mol D.0.200 mol
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。













