-
根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
| 步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJ•mol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJ•mol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
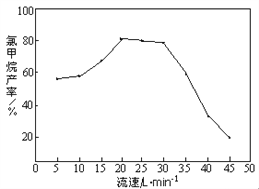
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 L•min-1~30 L•min-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
-
已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
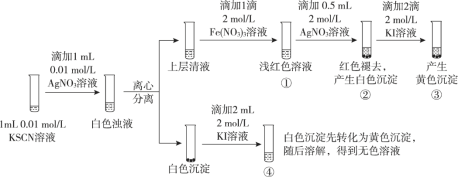
下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
-
已知:Ag++SCN-=AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
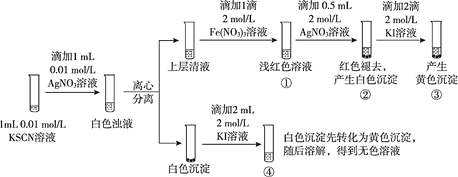
下列说法中,不正确的是
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3 +3Ag+ =3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
-
实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | 15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
-
为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
-
为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
-
某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。

回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性,证明SO2具有漂白性的现象为___________________________________。
(3)丁装置的作用是____________,写出其中发生主要反应的化学方程式:______________________。
-
某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。

回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,乙装置中品红溶液褪色,说明SO2具有_________性,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性。
(3)丁装置中发生主要反应的化学方程式:____________________________________________;其作用是______________________。
-
为了检验SO42-,甲、乙、丙、丁四位同学设计了如下四种方案,其中方案最优的是( )
A.方案甲:试液 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解
B.方案乙:试液 无沉淀(也无气泡)
无沉淀(也无气泡) 白色沉淀
白色沉淀
C.方案丙:试液 无沉淀
无沉淀 白色沉淀
白色沉淀
D.方案丁:试液 白色沉淀(过滤)
白色沉淀(过滤) 沉淀不溶解
沉淀不溶解
-
某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:
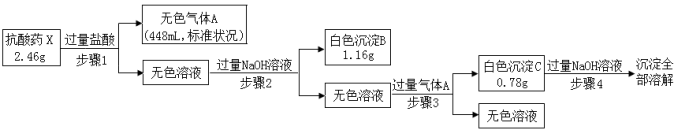
请回答下列问题:
(1)白色沉淀B的化学式是 。
(2)步骤3中生成沉淀C的离子方程式为 。
(3)X的化学式为 。
(4)该抗酸药不适合胃溃疡重症患者使用,原因是 。







