-
为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。
出现白色沉淀。
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。
溶液变为红色。
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。
现象a,且溶液红色变浅。
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。
出现黄色沉淀。
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
高二化学综合题中等难度题查看答案及解析
-
为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。
出现白色沉淀。
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。
溶液变为红色。
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。
现象a,且溶液红色变浅。
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。
出现黄色沉淀。
已知:25℃,Ksp(AgI,黄色)= 8.3×10‾17 ,Ksp (AgSCN,白色 )= 1.0×10‾12 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
高二化学综合题中等难度题查看答案及解析
-
根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤
现象
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置
出现白色沉淀
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液
溶液变为红色
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液
溶液浑浊、红色变浅
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液
出现黄色沉淀
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJ•mol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJ•mol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
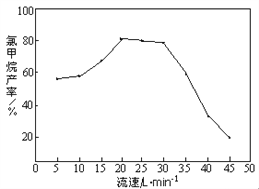
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 L•min-1~30 L•min-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
高二化学综合题中等难度题查看答案及解析
-
某研究小组以银盐为实验对象,研究难溶盐时进行了如下实验:
①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c:
②向滤液b中滴加0.1mol/LKI溶液。出现浑浊;
③向沉淀c中滴加0.1mol/LKI溶液,沉淀变为黄色;
④向AgI中滴加0.1mol/LNaCl溶液,无明显现象。
已知: 25℃时,AgCl 和AgI 的溶解度分别是1.5×10-4g 和3×10-7g
请回答:
(1)沉淀c是____________。
(2)步骤②中的现象说明滤液b中含有的微粒是________________。
(3)步骤③中反应的离子方程式是__________________________。
(4)根据实验,可以得出的结论是__________________。
高二化学填空题中等难度题查看答案及解析
-
某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下:
步骤和现象
现象
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液
出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液
沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水
沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为__________________________。
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3¯,还含有的离子有_________________。
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为_______________。沉淀转化的主要原因是______________。
(4)已知:Ag+ + 2NH3· H2O
Ag(NH3)2 ++ 2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因_____________。
(5)结合上述信息分析,下列预测不正确的是 。
A.在步骤Ⅳ之后,继续滴加浓硝酸后又有AgCl沉淀生成
B.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
C.若在白色沉淀Y中滴加NaOH溶液,沉淀也能溶解
高二化学实验题困难题查看答案及解析
-
将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
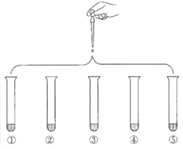
实验①:滴加4滴水,振荡
实验②:滴加4滴饱和FeCl3溶液,振荡
实验③:滴加4滴1 mol/L KCl溶液,振荡
实验④:滴加4滴1 mol/L KSCN溶液,振荡
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
高二化学单选题简单题查看答案及解析
-
将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
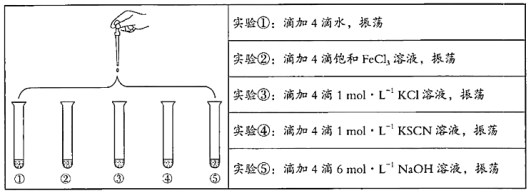
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
高二化学单选题中等难度题查看答案及解析
-
实验室中有一未知浓度的稀盐酸,某同学为测定该盐酸的浓度,在实验室中进行了如下实验。
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→_________→__________→装瓶→贴标签。
②称量________g氢氧化钠固体粉末,所需仪器有:托盘天平(带砝码和镊子)、___________、小烧瓶。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验
编号
NaOH溶液的浓度(mol/L)
滴定完成时,NaOH溶液滴入的体积(mL)
待测盐酸溶液的体积(mL)
1
0.10
29.80
20.00
2
0.10
30.00
20.00
3
0.10
30.20
20.00
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
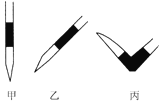
③排去碱式滴定管中气泡的方法应采用如图所示操作中的____________(选择甲、乙、丙填空),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失
高二化学实验题中等难度题查看答案及解析
-
某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)=4.5mol·L-1,反应均需要搅拌60min。
编号
温度/℃
加入某盐
H2SO4体积/mL
H2O体积/mL
铝粉加入量/g
铝粉溶解量/g
①
20
不加
40
0
2.0050
0.0307
②
80
不加
40
0
2.0050
0.1184
③
t1
不加
20
V1
2.0050
﹨
④
t2
5mL0.01mol·L-1
CuSO4溶液
20
V2
2.0050
﹨
(1)实验①和②的目的是____________。为了获得铝粉溶解量,还需要测量的数据是____________。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1=_______℃,V1=________mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=______℃,V2=______mL。
(4)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是________________。
高二化学实验题中等难度题查看答案及解析
-
某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)=4.5mol·L-1,反应均需要搅拌60min。
编号
温度/℃
加入某盐
H2SO4体积/mL
H2O体积/mL
铝粉加入量/g
铝粉溶解量/g
①
20
不加
40
0
2.0050
0.0307
②
80
不加
40
0
2.0050
0.1184
③
t1
不加
20
V1
2.0050
﹨
④
t2
5mL0.01mol·L-1
CuSO4溶液
20
V2
2.0050
﹨
(1)实验①和②的目的是___________________________。为了获得铝粉溶解量,还需要测量的数据是______________________________________________。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1=________℃,V1=________mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=_______℃,V2=______mL。
(4)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是________________。
高二化学实验题中等难度题查看答案及解析