-
(本题共14分)某工业废水中可能含有如下几种阴阳离子:
阳离子
Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子
Cl-、CO32-、NO3-、SO42-、SiO32-
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ________;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ________;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)Al + X + OH- =AlO2-+ NH3 + N2 + 。该反应的还原产物是 ________。若除去0.2mol X离子,要消耗铝 ________g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 ________。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
高三化学填空题困难题查看答案及解析
-
某工业废水中可能含有如下几种阴阳离子:
阳离子
Fe3+、Al3+、Fe2+、Ba2+、Na+
阴离子
Cl-、CO32-、NO3-、SO42-、SiO32-
现对该废水样品进行以下研究:
Ⅰ.取少量的废水于试管中,观察颜色,嗅气味,与普通水明显不同;
Ⅱ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅲ.若向II所得的溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅳ.若向II所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出IV的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH约为 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
高三化学填空题困难题查看答案及解析
-
某无色溶液中可能存在如下几种阴阳离子:
阳离子
Al3+、Fe2+、Ba2+、Na+、NH4+
阴离子
Cl—、CO32—、SO4
2—、NO3—、I—
现对该溶液样品进行以下研究:
Ⅰ.向溶液中加入稀盐酸后有无色气体生成,该气体遇空气变成红棕色;
Ⅱ.若向Ⅰ所得溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅲ.若向Ⅰ所得溶液中加入过量NaOH浓溶液并加热,产生有刺激性气味的气体,最终溶液无沉淀生成;
Ⅳ.向Ⅲ所得溶液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该溶液中一定存在的阳离子为 ,一定不存在的离子为 。
(2)检验溶液中可能还存在的阳离子的方法为 。
(3)写出实验Ⅰ发生反应的离子方程式: 。
(4)写出实验Ⅳ中生成白色絮状沉淀的化学方程式: 。
高三化学推断题简单题查看答案及解析
-
某废液阳离子只可能含有:Na+、NH4+、Ba2+、Cu2+、Fe2+、Fe3+、Al3+中的某几种,实验设计了下述方案进行处理,以回收金属,保护环境
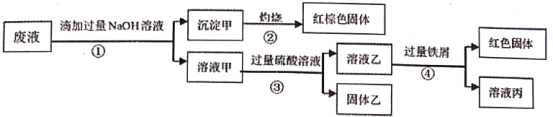
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解,下列说法正确的是:
A.根据步骤①中的现象,说明废液中一定含有Al3+
B.步骤②,由红棕色固体可知,废液中一定存在Fe3+
C.取溶液丙进行焰色反应,焰色为黄色,说明原溶液中一定含Na+
D.该废液一定含有NH4+、Ba2+、Cu2+
高三化学单选题困难题查看答案及解析
-
某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。
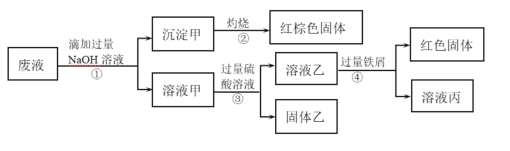
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
高三化学单选题中等难度题查看答案及解析
-
某化学实验室产生的废液中的阳离子只可能含有Na+、NH4+、Ba2+、Cu2+、Al3+、Fe2+、Fe3+中的某几种,实验室设计了下述方案对废液进行处理,以回收金属,保护环境。

已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是
A.根据步骤①的现象,说明废液中一定含有Al3+
B.由步骤②中红棕色固体可知,废液中一定存在Fe3+
C.沉淀甲中可能含有Al(OH)3
D.该废液中一定含有NH4+、Ba2+、Cu2+、Fe2+和Fe3+至少存在一种
高三化学单选题中等难度题查看答案及解析
-
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:(本题共9分)
① 用蓝色石蕊试纸检测该溶液,试纸显红色;
② 取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③ 取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④ 取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤ 取实验 ④ 后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:⑴在实验①中,下图所示的操作中正确的是___________(填代号)
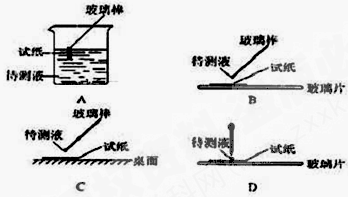
⑵根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是_________。
⑶写出与③实验有关的离子方程式:
③_____________________________________________________________
高三化学填空题简单题查看答案及解析
-
(本题共12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀盐酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)
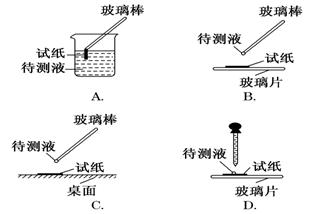
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③两个实验有关的离子方程式:
②________________________________;③_____________________________________
高三化学填空题简单题查看答案及解析
-
某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+

等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的).
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由.答:______.
(2)写出沉淀D的分子式:______.
(3)写出从溶液D生成沉淀E的反应的离子方程式:______.高三化学解答题中等难度题查看答案及解析
-
某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+

等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的).
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由.答:______.
(2)写出沉淀D的分子式:______.
(3)写出从溶液D生成沉淀E的反应的离子方程式:______.高三化学解答题中等难度题查看答案及解析