-
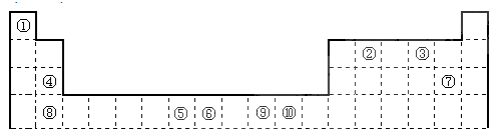
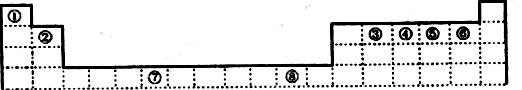
下表为周期表的一部分,其中的编号代表对应的元素,用化学用语回答以下问题。

(1)其中属于过渡元素的是_____________,比较②的氢化物与同族第3、4周期元素所形成的氢化物沸点高低并说明理由_____________
(2)②与③中第一电离能较小的元素是_____________;①和④形成的物质与⑤和⑥形成的物质晶体中熔点较高的是_____________。
(3)①形成的有机试剂在有机合成中有重要应用,但极易与O2、CO2等反应。下列说法不正确的是_____________(填字母序号)
a.CO2中键σ与π键的数目之比为1:1
b.游离态和化合态①元素均可由特征发射光谱检出
c.叔丁基锂([(CH3)3C]Li)中碳原子的杂化轨道类型为sp3和sp2
(4)如图一是上述元素形成的物质晶胞结构示意图,其化学式为_____________,其中Fen+的基态电子排布式为_____________,PO43-的空间构型为_____________
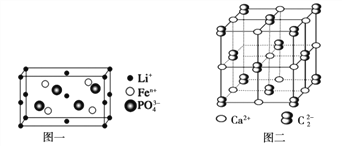
(5)金属①的晶体为体心立方晶胞,其配位数为_____________;若其晶胞边长为a pm,则锂晶体中原子的空间占有率是_____________
(6)上述元素形成的CaC2晶体的晶胞结构与NaCl晶体的相似(如图二所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长(粒子间距增加)。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____________
-
(15分)【化学---选修模块:物质结构与性质】
下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是________,其中心原子的杂化轨道类型是_______。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为________;该元素与元素①形成的分子X构形为________;X在①与③形成的分子Y中的溶解度很大,其主要原因是________。
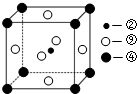
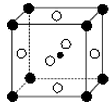
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为________(用对应的元素符号表示)。

-
下表为长式周期表的一部分,其中的编号代表对应的元素.请回答下列问题:
(1)表中属于d区的元素是______(填编号).
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图所示(图中②、④、⑨分别位于
晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示).
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是______.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键D.该氢化物分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为______;该元素与元素①形成的18电子的X分子(分子量32)的电子式为______;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为______.
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据. | 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
请回答:表中的金属元素是______(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是______.
-
下表为周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnn ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
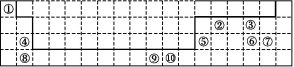
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。
-
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
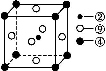
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图(图中②- 、④-
、④- 、⑨-
、⑨- ),则该化合物的化学式为________(用元素符号表示)。
),则该化合物的化学式为________(用元素符号表示)。
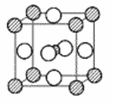
(3)某元素的基态特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为________ ________;该元素与元素①形成的分子X构形为 ________,X在①与③形成的分子Y中的溶解度很大, 其主要原因是________。X分子中中心原子为________杂化。
-
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(填编号)。
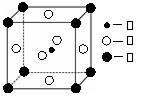 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
体心、顶点、面心),则该化合物的化学式为
________(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,
常把该氢化物的产量作为衡量石油化工发展水
平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X构形为________;X在①与③形成的分子Y中的溶解度很大,其主要原因是________。
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
请回答:表中的金属元素是________(填字母),其中化合价为+3价的是________(填字母);若A、B、C依次为同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
________。
-
下图为长式周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于ds区的元素是________(填编号).
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是________;③和⑦形成的常见化合物的化学键类型是________.
(3)元素⑧的外围电子排布式为________,该元素原子中未成对电子数为________.
(4)在周期表中位于对角线的元素的性质也有一定的相似性.试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________.
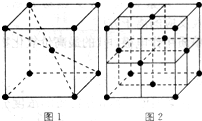
(5)在1183K以下,元素⑨形成如图1所示基本结构单元的晶体;1183K以上,转变为图2所示基本结构单元的晶体.
在1183K以下的晶体中,与元素⑨的原子等距离且最近的原子数为________;
在1183K以上的晶体中,与元素⑨的原子等距离且最近的原子数为________.
-
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):
(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为________。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式________,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式________。
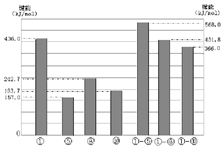
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而________(填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。
-
下图是门捷列夫长式周期表前四周期的结构,编号代表对应的元素。
请回答下列问题:
(1)图中编号为⑩的元素在周期表中的位置 ;图中编号为⑤的元素价电子层的电子排布式为 。
(2)表中属于s区的元素是 (填编号)。
(3)科学发现,②④⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构如图(图中②- 、④-
、④- 、⑨-
、⑨- ),则该化合物的化学式为: (用元素符号表示)。
),则该化合物的化学式为: (用元素符号表示)。
(4)编号为⑥的元素原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,与钙元素原子或离子形成配合物的分子或离子应具备的结构特征是 ;常见配体CN-中C原子的杂化轨道类型是 。
(5)某元素的特征电子排布式为nsnnpn+1,该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
(6)用价层电子互斥理论预测X的分子形状为 。
-
下表为元素周期表的一部分,其中编号代表对应的元素。
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的电子排布图为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,(写出一种即可)其VSEPR构型为 。
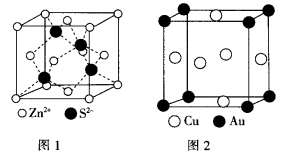
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中, 的配位数为 。
的配位数为 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1m ol(SCN)2分子中含有共价键的数目为 。
铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA 的代数式表示)g· 。
。









 (2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的







