-
己知下表为25℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka= 1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为: 2ClO-+CO2+H2O=2HClO+CO32-
B. 相同浓度 的 CH3COONa 和 NaClO 的混合溶液中,c(CH3OOH)+c(HClO) =c(OH-)-c(H+)
C. 向0.1mol/LCH3COONa溶液中加入少量水,溶液pH增大
D. 25℃时,0.10mol/LNa2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)=c(CO32-)+ c(HCO3-)+c(H2CO3)
-
己知下表为25℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
B. 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)=c(OH-)-c(H+)
C. 25℃时,0.10mol·L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)=c(CO32-)+ c (HCO3-)+c(H2CO3)
D. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中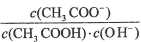 增大
增大
-
依据下表25℃时某些弱酸的电离平衡常数,判断下列说法正确的是
| CH3COOH | HC1O | H2CO3 |
| Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7 Ka2=4.7×l0-11 |
A. 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O==2HC1O+CO32-
B. 相同浓度的CH3COOH和NaClO的溶液中,水的电离程度前者大
C. 向0. lmol • L-l的CH3COOH溶液中滴加NaOH溶液至pH = 5,此时溶液的 c(CH3COOH):c(CH3COO-) =5∶9
D. 常温下,0• lmol • L-1 的 NaHC2O4 溶液 pH =4: c(HC2O4-) >c(H+)>c(H2C2O4)>c(C2O42-)
-
根据表提供的数据,下列判断正确的是
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A H++HA-;HA-
H++HA-;HA- H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:
C(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
-
已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是

| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
-
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.等物质的量浓度的NaClO和NaHCO3 混合溶液中 c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为ClO-+CO2+H2O=CO32-+2HClO
C.25℃时,甲基橙滴入0.1mol/L的次氯酸溶液中,溶液呈红色
D.结合H+的能力:CH3COO->ClO->CO32-
-
下列是25 ℃时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5
C. 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32 -+2HClO
D. pH相同的CH3COONa溶液、NaClO溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3) >c(NaClO ) >c(NaOH )
-
下表是25°C时某些弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7
Ka2=5.6×10-11 |
A.物质的量浓度相同的CH3COOH和HClO溶液,pH前者比后者大
B.向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COO-):c(CH3COOH)=9:5,此时所得溶液pH=5
C.相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
D.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32-
-
巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |

A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
-
(下列是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10﹣10 | Ksp=9.0×10﹣12 | Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A.相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1 mol•L﹣1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液的pH=5
D.向浓度均为1.0×10﹣3 mol•L﹣1的KCl和K2CrO4混合溶液中滴加1.0×10﹣3 mol•L﹣1的AgNO3溶液,CrO42﹣先形成沉淀
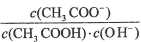 增大
增大
