-
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。

(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4________H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为________、 ________,
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式 ________
(4)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为_________ ;
-
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质,右图是元素周期表的一部分。

(1)阴影部分元素在元素周期表中的位置为第________族。根据元素周期律、预测;酸性强弱H2AsO4________H3PO4(用“>”或“<”表示)
(2)元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度)。请判断:在相同条件下Se与H2反应的限度比S与H2反应限度________。(选填“更大”、“更小”或“相同”)
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________
(4)下列说法正确的是________
A.C、N、O、F的原子半径随着原子数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
-
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物 浓度均为
浓度均为 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。
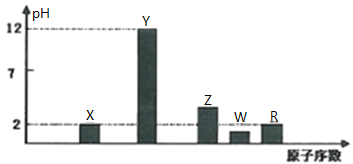
 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
 元素Y和W形成的
元素Y和W形成的 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如 、
、 、COS等。
、COS等。
 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______ 填序号
填序号
A.S与 发生化合反应比C与
发生化合反应比C与 化合更容易
化合更容易
B.酸性:
C. 中碳元素为
中碳元素为 价,硫元素为
价,硫元素为 价
价
 铅
铅 、锡
、锡 、锗
、锗 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
 锗的原子序数为______。
锗的原子序数为______。
 它们
它们 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______ 填化学式
填化学式 。
。
 羰基硫
羰基硫 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和 相似。
相似。
 用电子式表示羰基硫
用电子式表示羰基硫 的形成过程:______。
的形成过程:______。
 羰基硫
羰基硫 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
-
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

元素R在周期表中的位置是________________________。
元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为______________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
①羰基硫(COS)的电子式为:______________。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为______________;若气体a为单质,反应II的离子方程式为________________________________________________。
-
元素的性质反映了元素的原子结构,并体现了其在元素周期表中的位置。下列说法正确的是
A.元素周期表中非金属元素都在短周期
B.N、P、As得电子能力减弱。最高价氧化物对应水化物均可表示为H3YO4
C.元素周期表中过渡元素只包括金属元素
D.A一1zX、AzX、A+1zX在元素周期表中的位置、原子核外电子排布相同,但性质不同
-
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
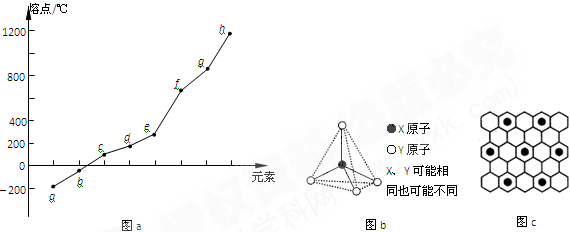
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为________;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为________。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33.35 | 164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为________。
-
元素在周期表中的位置,反映了元素的原子结构和性质.下列说法正确的是( )
A.处于元素周期表金属和非金属分界线附近的为过渡元素
B.第三周期主族元素的最高正化合价等于它的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.最外层有2个电子的元素一定是金属元素
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
-
下表是元素周期表中的一部分。
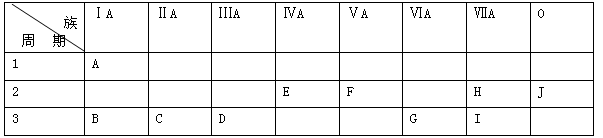
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是 。
(4)在B、C、D、G、I中,原子半径最大的是 。
(5)元素C与I形成的化合物的电子式是 。







